ترمیم بافت استخوان با فناوری نانو در البرز
محققان ایرانی موفق به ترمیم بافت استخوانی با نانو بیوسرامیکهای نوین شدند.
عضو هیأت علمی پژوهشگاه مواد و انرژی گفت: با همکاری مرکز تحقیقاتی درمانی ناباروری دانشگاه علوم پزشکی یزد به بررسی ترمیم بافت استخوان آسیب دیده در موش صحرایی با بیوسرامیک نانوساختاری بر پایه کلسیم منیزیم سیلیکات (مرونیت) و مقایسه آن با پودر هیدروکسی آپاتیت تجاری پرداختیم که مهمترین کاربرد این طرح در صنایع پزشکی و مهندسی پزشکی خواهد بود.
«علی حافظی» افزود: بیوسرامیکهای فسفات کلسیم، بهویژه پودرهیدروکسی آپاتیت (HA)، به دلیل شباهت زیاد به ترکیب معدنی موجود دربافتهای سخت، بهطورگسترده بهعنوان ایمپلنت استخوان مورد استفاده قرارمیگیرد؛ با این حال، محدودیتهایی نظیر مقاومت فشاری و تافنس شکست پایین کاربردهای گستردهتر آن را برای ترمیم بافت استخوان محدود کرده است.
وی اضافه کرد: درسالهای اخیر، مرونیت به دلیل افزایش تکثیر سلولی بیشتر و خواص مکانیکی بهتر توجه بسیاری از محققان را به خود جلب کرده است.
همچنین مطالعات انجام شده نشان داده است که استئوبلاستها (سلولهای استخوانساز) فعالیت تکثیری بهتری روی مرونیت نسبت به HA از خود نشان میدهند.
عضو هیأت علمی پژوهشگاه مواد و انرژی و محقق این طرح در این باره اظهارکرد: در این کارتحقیقاتی که در ادامه پایاننامه دکترای من ومنتج از طرح پژوهشی مشترک با مرکز تحقیقاتی درمانی ناباروری دانشگاه علوم پزشکی یزد بود، ما به دنبال بررسی میزان استخوانسازی ترکیبی برپایه کلسیم منیزیم سیلیکات یا همان مرونیت و مقایسه نتایج آن با پودر هیدروکسی آپاتیت که در ترمیم استخوان متداول است، بودیم.
حافظی درمورد مراحل انجام این تحقیقات تصریح کرد: درابتدا مرونیت به روش سل ـ ژل سنتزشد و خواص فیزیکی آن مورد ارزیابی قرار گرفت؛ سپس با انتخاب ۲۴ موش صحرایی ۳ تا ۴ ماهه با وزن مشخص و تقسیم آنها به ۳ گروه ۸ تایی حفرههایی در استخوان ران آنها ایجاد شد.
وی ادامه داد: در ادامه در یک گروه این حفرهها با پودرمرونیت و درگروهی دیگر با پودر هیدروکسی آپاتیت پرشد؛ گروه آخرهم بدون اینکه حفره با مادهای پرشود، بهعنوان گروه کنترل انتخاب شد سپس با گذشت زمان ۲ و ۸ هفته مطالعات هیستولوژیکی روی این گروهها صورت گرفت و به مقایسه نتایج به دست آمده پرداخته شد.
محقق این طرح افزود: نتایج نشان داد که استخوانسازی و رگزایی مرونیت درمحدوده گستردهترو با سرعت بیشتری در مقایسه با گروههای دیگر ایجاد شد چرا که فعالیت استئوبلاستها روی مرونیت نانوساختار درمقایسه با هیدروکسی آپاتیت میکرونی افزایش قابل ملاحظهای داشت. این محقق ادامه داد: بنابراین با انجام بررسیهای تکمیلی میتوان به کاربرد این ماده بهعنوان جایگزین مناسب استخوان با قابلیت رگزایی و افزایش فعالیت سلولی امیدوار بود. به گفته حافظی، وی و همکارانش در ادامه این طرح به دنبال ساخت داربستهایی از کامپوزیتهای این ماده به همراه پلیمرهای زیست سازگار هستند.
موفقیتی دیگر در مسیر ترمیم بافتهای استخوانی با فناوری نانو
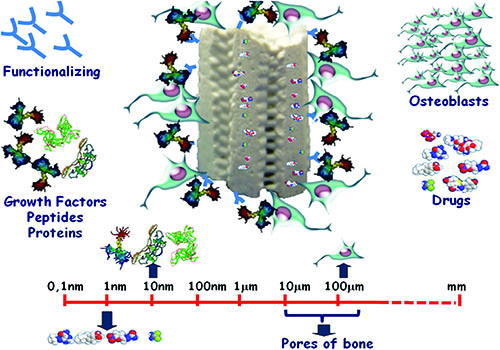
محققان دانشگاه شیراز در پژوهشی آزمایشگاهی، نانوکامپوزیت پروتئینی را تولید کردهاند که میتوان از آن بهمنظور ترمیم بافتهای استخوانی استفاده کرد.
سادات شجاعی، مجری طرح اظهار کرد: مهندسی بافت علمی است که با به کارگیری روشهای نوین به تولید بافتهای بدن بهمنظور ترمیم آسیبدیدگی آنها میپردازد. بدین صورت که با ساخت داربستهای سهبعدی به شکل بافتهای مختلف بدن و اعمال سلولهای قابل رشد درون آنها، زمینه رشد سلولها در محیط بدن را فراهم میآورند. ترمیم بافتهای استخوانی یکی از مهمترین شاخههای این علم بشمار میرود که تا کنون تحقیقات گستردهای در این زمینه انجام شده است.
وی با اشاره به گامهای مهم برداشته شده بهسوی استفاده از مهندسی بافت جهت درمان آسیبهای شدید اسکلتی به صورت کلینیکی گفت: هدف از انجام این طرح، تولید و معرفی یک داربست استخوانی است که عملکرد آن از نقطه نظرهای خواص مکانیکی، زیست سازگاری، زیست فعالی و قابلیت بازسازی استخوان نسبت به نمونههای مشابه بهبود یافته است.
مجری طرح در رابطه با خصوصیات برتر این داربست استخوانی نانوکامپوزیتی افزود: ساختار جدید معرفی شده در طرح حاضر، قابلیت این را دارد که تعداد بسیار بیشتری از سلولهای استخوانی را در حجم کم جای دهد. بهعلاوه که خواص مکانیکی داربستهای سنتی را نیز داراست. بر همین اساس، از کارایی بیشتری برای بازتولید بافت طبیعی استخوان برخوردار است.
وی با تاکید بر اینکه برخی از خواص مکانیکی و زیستی این نانوکامپوزیتها در مقایسه با نمونههای مشابه بهینه شده است، تصریح کرد: هیدروژلهای پروتئینی به دلیل خواص مکانیکی بسیار ضعیف عموماً تنها برای ترمیم بافتهای نرم مورد توجه هستند. با این حال این مواد خواص بینظیری از قبیل برهمکنش عالی با سلولها و توانایی کپسوله کردن تعداد بسیار زیادی سلول را در حجم کم دارا هستند. نتیجه حاصل از این طرح یک داربست سهبعدی نانوکامپوزیتی متشکل از نانوذرات استخوانی، هیدروژل پروتئینی و نانوالیاف پلیمری است. در واقع نانوالیاف کامپوزیتی پلیمری نقش استحکامبخشی مکانیکی را ایفا کرده و هیدروژل پروتئینی خواص زیستی داربست را تأمین میکند.
دکتر سادات شجاعی درباره روند دستیابی به اهداف مورد نظر این پژوهش گفت: ابتدا نانوذرات استخوانی (هیدروکسی آپاتیت) با قابلیت زیست سازگاری و زیست فعالی بالا با روشی بهینه سنتز شدند تا بتوان از آنها برای ساخت داربستی زیست فعال استفاده کرد. در ادامه یک هیدروژل پروتئینی با روشهای شیمیایی خاص اصلاح شد، تا قابلیت ایجاد پیوندهای عرضی در مولکولهای پروتئین ایجاد شود. همچنین برای شبیهسازی هر چه بیشتر داربست استخوانی به ECM طبیعی انسان، با بهکارگیری روش الکتروریسی، یک لایه نانوکامپوزیتی الکتروریس شده از یک پلیاستر و نانوذرات استخوانی تهیه شد. در نهایت یک قطعه سهبعدی پیچیده متشکل از هیدروژل پروتئینی اصلاح شده، نانوذرات استخوانی و لایه نانوکامپوزیتی الکتروریس شده تولید شد و آزمونهای مربوطه جهت ارزیابی عملکرد این قطعه صورت گرفت.
مجری طرح خاطرنشان کرد: بر اساس نتایج تحلیلهای سلولی، سلولهای استخوانی به مرور زمان تشکیل یک شبکه سهبعدی را در سرتاسر ساختار کامپوزیتی میدهند که نتیجه مستقیم آن تسریع در روند بهبود استخوان آسیب دیده خواهد بود. بهعلاوه، به دلیل حضور نانوذرات زیست فعال توزیع شده در لایههای داربست، ایجاد جوانههای استخوانی در زمانی کوتاه میسر شده است.
نتایج این تحقیقات که حاصل تلاشهای دکتر مهدی سادات شجاعی، عضو هیأت علمی دانشگاه شیراز و دکتر محمدتقی خراسانی و دکتر احمد جمشیدی از اعضای هیأت علمی پژوهشگاه پلیمر است، در مجله Chemical Engineering منتشر شده است.
در دانشگاه علوم پزشکی تهران؛
استخوان آسیب دیده با فناوری نانو ترمیم می شود
محققان دانشگاه علوم پزشکی تهران با همکاری پژوهشگران دانشگاه صنعتی بابل موفق به ساخت نانوکامپوزیت هایی شدند که می تواند استخوان آسیب دیده را ترمیم کند.
به نقل از ستاد ویژه توسعه فناوری نانو،بازسازی بافت استخوان معیوب و عوارض مربوط به عمل جراحی همچون عفونت محل شکستگی، از نگرانیهای عمده در جراحی ارتوپدی است. از این رو، توسعهکامپوزیتهای ضدباکتریایی به منظور بهبود فرایند استخوانسازی اهمیت بالایی دارد.
دکتر شیما توکل، یکی از مجریان طرح «طراحی و ساخت نانو کامپوزیت هایضد باکتری برای ترمیم استخوان» گفت:در این مطالعه دو گونه نانوکامپوزیت مختلف به منظور ترمیم استخوان و کاهش عفونت در محل ضایعه طراحی شدند. مواد استفاده شده در این کامپوزیتها در مقادیر معین، کاملاغیرسمی و سازگار با بدن هستند واز طرفی قیمت تمام شدهنانوکامپوزیت هم پایین و مقرون به صرفه است.
وی ادامه داد:در این طرح نانوکامپوزیت هیدروکسی آپاتیت-کیتوسان حاوی نانوذرات نقره و سیلیسیوم توسط یک روش هیبریدیزاسیون مولکولی آماده شد.
به گفته وی، هدف از این کار نشان دادن اثر اندازه، زبری سطح و ساختار شیمیایی نانوکامپوزیتهای ذکر شده در سمیت سلولی و فعالیت ضدباکتری بر سلولهای استخوانساز (استئوبلاست) انسان و باکتری اشرشیاکولی بود.
وی افزود: نتایج نشان داده که نانوکامپوزیت حاوی نانوذرات نقره نسبت به نانوکامپوزیت حاوی سیلیسیوم، درصد زنده بودن سلول و فعالیت ضدباکتری بالاتری را القا میکنند.
به گفته توکل، ادغام نانوذرات نقره با نانوکامپوزیت، مانع از انتشار سریع یونهای نقره شده و پتانسیل ایجاد سمیت در سلولها را محدود میکند. در نتیجه، توان بازسازی بالای استخوان نانوکامپوزیت نقره و زیست سازگاری خوب و همچنین فعالیت ضدباکتری مناسب، آن را به گزینهمناسبی به عنوان پرکننده در محل شکستگی استخوان آسیب دیده تبدیل می کند.
وی خاطرنشان کرد: با تکمیل مطالعات در استفاده از این نتایج و تولید انبوه این ماده، میتوان از طریق جلوگیری از مشکلات مربوط به عفونت استخوانی و تسریع روند ترمیم استخوان، به کاهش هزینههای وارد شده بر سیستم سلامت کشور کمک کرد.
توکل نحوهساخت و بررسی این نانوکامپوزیتها گفت: در این مطالعه، نانوذرات نقره و یا پلی دی میتیل سیلوکسان به ترکیب بهینهکیتوسان- نانوهیدروکسی آپاتیت اضافه شد و اجازه داده شد تا ترکیب کامپوزیتی بصورت درجا ساخته شود. اندازه ذرات، زبری سطح، تولید اکسیژن واکنش پذیر و زیست فعالی نانوکامپوزیتها توسط پراش اشعه X، میکروسکوپ نیروی اتمی، روش DPPH و طیف سنجی مرئی UV-SEM، مورد مطالعه قرار گرفت.
وی عنوان کرد: آزمون شمارش کلنیهای باکتریایی، آزمون MTT و آزادسازی لاکتات دهیدروژناز (LDH) نیز به عنوان آزمایش فعالیت ضد باکتری و زیست سازگاری انجام شد.
بر اساس اعلام ستاد نانو، مطالعات نشان دادهاند که درکنار خاصیت ضد باکتریایی نانونقره، نانونقره خاصیت ترمیم کنندگی استخوان را نیز دارد. همچنین این نانوکامپوزیت اگرچه خاصیت ضدباکتریایی خوبی نشان میدهد، اما بر روی سلولهای یوکاریوت(مثل سلول پستانداران و جانورانی بغیر از باکتری و ...) اثرات صدمه زنندهای ندارد. در نتیجه میتوان چنین فرض کرد که این نانوکامپوزیت میتواند منجر به ترمیم استخوان و جلوگیری از عفونت در محل ضایعهاستخوانی شود. البته برای بررسی این فرضیه باید مطالعات بیشتری صورت بپذیرد.
این نانوکامپوزیت زیست سازگار و حاوی نانوذرات ضد باکتری است و در بررسیهای آزمایشگاهی قادر به جلوگیری از رشد باکتری و بخش دیگر نانوکامپوزیتی آن قادر به بازسازی استخوان در محل آسیب دیده بوده است.
این مطالعات حاصل تلاشهای دکتر شیما توکل، دکتر سید مهدی رضایت، دکتر محسن جهانشاهی- عضو هیات علمی دانشگاه صنعتی بابل و مهندس محمدرضا نیک پور است. نتایج این کار در مجله
Journal of Nanoparticle Research)جلد ۱۶، شماره ۱، سال ۲۰۱۴، صفحات ۱-۲۶۲۲ تا ۱۳-۲۶۲۲) به چاپ رسیده است.
دستاورد محققان کشور در ترمیم استخوان با نانو داربست مرجانی
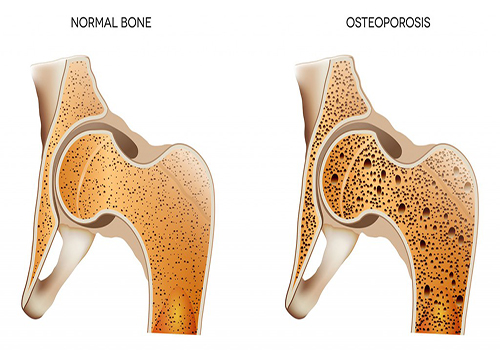
محققان دانشگاه صنعتی امیرکبیر با استفاده از ترکیب مرجان دریایی در بستر پلیمری نانولیفی داربستهایی را عرضه کردند که قادر است در کمتر از 3 ماه بافت یکپارچه استخوانی را تولید کند.
فاطمه حجازی محقق طرح با بیان این که در این تحقیقات داربستهای نانولیفی برای ترمیم بافت استخوان تولید کردیم، گفت: داربستهای نانو لیفی به دلیل شباهت ساختاری به ماتریس برون سلولی طبیعی بدن، بسیار مناسب برای رشد و تکثیر سلولها است.
وی با بیان این که در صورت طراحی سهبعدی این داربستهای نانولیفی سلولها میتوانند در یک محیط سه بعدی رشد کرده و عملکردهای طبیعی خود را بیان کنند، اظهار کرد: از این رو در این مطالعات ما از ساختارهای سه بعدی نانو لیفی بهره بردیم تا با ترغیب سلولها به رشد، تکثیر و تمایزات استئوژنیک، بازسازی بافت استخوان را ارتقاء بخشیده و ترمیم آسیب استخوانی را تسریع بخشیم.
محقق طرح با تاکید بر این که در این پروژه از روش الکتروریسی اصلاح شده استفاده کردیم، خاطرنشان کرد: با استفاده از این روش توانستیم داربستهای نانو لیفی سه بعدی و ضخیم تولید کنیم تا امکان استفاده از آنها برای هر نوع آسیبی با هر ابعادی فراهم شود.
وی از کاربرد مرجان دریایی در این داربستها برای اولین بار خبر داد و یادآور شد: در کنار فاز پلیمری داربست از مرجان دریایی استفاده شد؛ چرا که مرجانها به دلیل ساختار ویژه خود خواص استخوان سازی شدیدی در داربست ایجاد میکند که این امر به بازسازی استخوان آسیب دیده کمک میکند.
حجازی با تاکید بر این که در این طرح از مزایای ساختارهای پلیمری نانولیفی همراه با خواص استئوژنیک مرجان دریایی برای ترمیم نقصهای استخوانی بهره جستیم، توضیح داد: استفاده در زمینههای پزشکی و به میزان بسیار کم از مرجانهای دریایی خلیج فارس دریچه جدیدی در استفاده بهینه از این منبع ملی میگشاید.
این محقق دانشگاه صنعتی امیرکبیر اضافه کرد: داربستهای تهیه شده از خواص مکانیکی بالایی برخوردارند و تا زمان ترمیم بافت استخوان قادر به تحمل بارهای وارده هستند.
وی ادامه داد: مطالعات سلولی برون تنی (In Vitro) نشان دادند که این داربستها هیچ سمیتی برای بدن ایجاد نکرده و بستر مناسبی برای رشد و تکثیر و تمایز سلولها بودند. به علاوه، مطالعات درون تنی (In Vivo) از حضور این داربستها در نقیصه جمجمهای مدل حیوانی موش صحرایی حاکی از شکلگیری بافت کامل و یکپارچه استخوان در کمتر از 3 ماه بود.
كاهش ۵۰ درصدی زمان ترميم بافتهای استخوانی با فناوری نانو
محقق دانشگاه امیرکبیر موفق به ساخت سامانه نانوکامپوزیتی به منظور رهایش کنترل شده داروی پوکی استخوان، کاهش عوارض دارویی و كاهش ۵۰ درصدی زمان بهبود و ترميم بافتهای آسيب ديده استخوانی شد.
سید محسن رضوی نیا، دانش آموخته کارشناسی ارشد دانشکده مهندسی پزشکی دانشگاه صنعتی امیرکبیر از سال۱۳۹۰کار بر روی ساخت سامانه نانوکامپوزیتی LDH/Gelatin (هیدروکسید دو گانه لایه ای / ژلاتین) را آغاز کرد تا از طریق آن به فرآیند رهاسازی کنترل شده داروی آلدرونیک اسید برای تسریع در درمان بافت استخوانهای آسیب دیده و پوکی استخوان دسترسی پیدا كند.
وی با بیان اینكه سامانه دارو رسان به بافتهای آسیب دیده استخوانی در این طرحبه صورت ایمپلنت (كاشتنی) ساخته شده است، افزود:ماده LDH در دنیا ساخته می شود اما خصوصیات ماده ای كهتولید كردیم، منحصر به فرد است و با روش سنتزی جدیدی برایاولین بار در دنیا بع نتیجه رسیده است.
وی با بیان اینکه ماده پایه حامل این سامانه كه هیدروكسید دوگانه لایه ای است و كاربردهای متعددی دارد،گفت: به این ترتیبآنیونی که بین لایه ها قرار گرفته را با استفاده از تكنیكهای خاص،از میان لایه های ساختاری ماده خارج و دارو را جایگزین آن كرده ایم.
رضوی نیا ادامه داد: لایه های ماده حامل در این سامانه دارو رسان، در شرایط اسیدی از هم باز می شود و آنیون بین آنها آزاد خواهد شد که ما از همین خاصیتدر pH و دمای خاصاستفاده كردیم تا دارو در محلی كه مدنظر ماست آزاد شود. بنابراین زمان رهایش و تخریب این سامانه كاملا تحت كنترل ما خواهد بود.
وی خاطرنشان كرد: خاصیت دیگر این ماده موجب می شود كه به محض قرار گرفتن در محیط بازی، آنیون موجود در اطراف را جذب كرده و به ساختار اولیه برگردد از این رو دیگر بافتهای سالم بدن را تحت تاثیر قرار نمی دهد.
وی هدف نهایی از طرح تحقیقاتی خود را كاهش مضرات و اثرات جانبی داروهای ضد سرطانی عنوان كرد و گفت: در حال حاضر داروهای ضد سرطان و به ویژه شیوه های شیمی درمانی به گونه ای است كه تمام سیستم بدن را تحت تاثیر قرار می دهد و علاوه بر نقاط سرطانی، بافت های سالم بدن را نیز متاثر می سازد كه عوارض جانبی زیادی برای بیماران به دنبال دارد.
رضوی نیا كاهش عوارض مصرف دارو را از مزایای سامانه دارو رسان ذكر كرد و افزود: ماده LDH تولید شده كاملا زیست سازگار است و با استخوان سازگاری دارد. همچنین این ماده موجب افزایش و تسریع در رشد و بازسازی بافتهای استخوانی می شود.
وی درباره نقش این دارو رسان نانو كامپوزیتی در كاهش عوارض مصرف داروهای ضد سرطان گفت: هنگام مصرف داروهای ضد سرطان، در روزهای اولیه مقدار زیادی از دارو در بدن بیمار آزاد می شود كه مطلوب ما نیست و باید به تدریج به دوز خاصی برسد و در محدوده معینی عمل كند.
وی ادامه داد: با كاشتن این سامانه دارو رسان در موضع سرطانی، علاوه بر کاهش مصرف دارو می توان رهایش آن را كنترل كرد كه در چه مدت زمانی، چه مقدار دارو آزاد شود.
وی با بیان اینكه سامانه دارو رسان نانوكامپوزیتی، مراحل تست آزمایشگاهی و تست حیوانی بر روی موش و خرگوش را با موفقیت پشت سر گذرانده است، گفت: تست انسانی در مرحله بعدی قرار دارد تا برای مبتلایان به پوكی یا شكستگی استخوان و همچنین سرطان استخوان مورد استفاده قرار گیرد.
رضوی نیا تصریح كرد: با توجه به ویژگی زیست تخریب پذیری و امكان كنترل كامل این ماده، بعد از انجام ماموریت می توان بدون آسیب به بافت بدن، آن را تخریب كرد در صورتیکه هیچ زیانی به بیمار نرسد.
تکنیک جدید ساخت داربست متخلخل جهت ترمیم بافت استخوان

نوعی داربست متخلخل از جنس ژلاتین/نانو هیدروکسی آپاتیت جهت ترمیم بافت استخوان به دست پژوهشگران ایرانی طراحی و ساخته شد. تکنیک ترکیبی ساخت داربست استفاده شده در این تحقیقات منجر به بهدست آوردن نوعی ساختار متخلخل مناسب برای داربست بافت استخوان میشود.
این تحقیق در محدوده دانش مهندسی بافت که هدف آن بازسازی و ترمیم بافتهای از دست رفته است، تعریف شده بود. هر سیستم مهندسی بافت شامل سه جزء اصلی داربست، سلول و فاکتور رشد است. در این پروژه، هدف طراحی و ساخت نوعی داربست مناسب جهت ترمیم بافت استخوان از جنس ژلاتین و نانوذرات هیدروکسی آپاتیت بوده است.
در ساخت این داربست از نانوذرات هیدروکسی آپاتیت در زمینه ژلاتین استفاده شده است. استفاده از این نانوذرات به دلیل سطح آزاد ویژه بسیار بالایی که از ذرات نانو سراغ داریم از چند جهت باعث بهبود خصوصیات داربست مربوطه میگردد. از نظر مهندسی کامپوزیت تقویت شونده با نانوذرات یاد شده، پتانسیل تقویت کنندگی داشته و با توجه به خصوصیات بیولوژیکی شناخته شده از هیدروکسی آپاتیت در زمینه قابلیت هدایت و رشد استخوان، کاهش سایز ذرات تا ابعاد نانو باعث افزایش این خاصیت از این ماده در ساختار نانوکامپوزیتی داربست مذکور میشود.
دکتر محمود اعظمی، استادیار گروه مهندسی بافت دانشکده فناوریهای نوین پزشکی دانشگاه علوم پزشکی تهران، مراحل این تحقیقات را این گونه شرح داد: «در مرحله اول به طراحی و ساخت داربست مناسب پرداخته شد. در این قسمت با بهرهگیری از ترکیب روشهای ریختهگری حلال و فریزدراینگ و نهایتاً لایه چینی نوعی داربست متخلخل با ساختار مناسب جهت رشد استخوان تهیه گردید و سپس با آزمونهای غیر بیولوژیکی و با استفاده از روشهای متداول مشخصهیابی مواد داربست ساخته شده مورد بررسی قرار گرفت. به منظور بررسی خصوصیات بیولوژیکی نظیر زیست سازگاری داربست ساخته شده و همچنین پتانسیل آن در القای رشد و تکثیر سلولهای استخوانی آزمونهای بیولوژیکی برون تن (in vitro) انجام گردید. آزمونهای درون تن نیز در مدل حیوانی موش و در ناحیه کالواریا به منظور بررسی قابلیت ترمیم بافت استخوان بواسطه حضور این داربست در محل ضایعه مورد بررسی قرار گرفت.»
تکنیک ترکیبی ساخت داربست استفاده شده در این تحقیقات منجر به بهدست آوردن نوعی ساختار متخلخل مناسب برای داربست میگردد. به گفته اعظمی بعد از این مقاله تحقیقات بیشتر در راستای سنجش درون تن محصول ساخته در مدلهای حیوانی بزرگتر نظیر خرگوش انجام شده است و در صورت امکان باید بر روی مدلهای حیوانی بزرگتر یا انسان مورد بررسی قرار گیرد. در صورت تایید این محصول در این آزمایشات و آزمایشات پیشرفتهتر، این محصول ارائه شده در این تحقیقات قابلیت ترمیم استخوانهای کوچک از دست رفته ناشی از بیماری، تصادف و... در انسان را خواهد داشت.
این کار تحقیقاتی تاکنون منجر به سه مقاله علمی در مجلات معتبر و ثبت اختراع در داخل کشور شده است. یکی از نتایج اخیر این کار تحقیقاتی که به دست دکتر محمود اعظمی و همکاران وی صورت گرفته است، درمجله
Journal of biomaterials science ,polymer edition (ژوئن 2012) منتشر شده است.
این خبر در نشریه ماهنامه فناوری نانو شماره 193در تاریخ 1392/08/15 به چاپ رسیده است.




















