
طراحی دارو چیست؟
برای توضیح دقیق اینکه طراحی دارو چیست باید یکسری توضیحات را ارائه دهیم تا بصورت پایه ای تر مفهوم طراحی دارو و ساز و کار آن را درک کنید.
طراحی نوعی مولکول است که به صورت هدفمند می تواند پروتئین یا هر نوع مسیر متابولیکی را فعال و یا غیر فعال کند. دارو هر نوع ترکیب خارجی است که وارد میشود که می تواند در مسیرهای متابولیکی تغییر ایجاد کند و همچنین می تواند باعث بهبود سلامت انسان و یا حتی باعث زیان شود. طراحی دارو مرحله اول در فرآیند طراحی و ساخت دارو است که توسط نرم افزار های دقیق تخصصی صورت گرفته و اثر گذاری دارو و میزان آن، عوارض جانبی، سمیت دارو طی این مرحله سنجیده میشود. همچنین امکان بهینه سازی دارو در این محیط وجود دارد. قبل از آنکه بتوانیم دارویی را طراحی کنیم نیاز داریم که سطوح مختلف مکانیسم سلول از جمله ژن، ژنوم، متابولیسم و. . . را بشناسیم. بعد از شناسایی مسیر متابولیکی و پیدا کردن مسیر یا مولکول هدف باید به شناسایی ساختار مولکول پرداخت. به عنوان مثال اگر آنزیمی را میخواهیم مورد هدف قرار دهیم و آن را inhibit کنیم ابتدا باید ساختار آنزیم مورد مطالعه قرار گیرد و همچنین سوبسترایی که به این آنزیم متصل می شود که برای مطالعه ساختار سه بعدی و مولکول های پروتئینی از دیتا بانک PDB استفاده می نماییم. در نتیجه باید مولکولی را طراحی کنیم که میزان affinity آن از سوبسترای آنزیم بیشتر باشد در دیتا بانک Pubchem مولکول هایی را معرفی می کند که میتوانند در جایگاه فعال آنزیم قرار گیرند که به این مولکول ها hit molecular گفته می شود. سپس در محیط PYRX شکل های مختلف لیگاندی را که طراحی نموده ایم با جایگاه فعال آنزیم بررسی می کنیم و بهترین حالت انتخاب می شود(به این عمل Docking گفته می شود) در این مرحله affinity نیز مورد بررسی قرار می گیرد. بعد از این مراحل باید میزان سمیت دارو را سنجید. در ویرایش مولکولی که طراحی می کنیم باید به این نکات توجه کرد که این مولکول بیش از اندازه آبدوست یا آبگریز نشود که اگر بیش از اندازه ابدوست باشد از غشاء سلول عبور نکرده و چنانچه بش از حد آبگریز باشد در خون جریان نمی یابد و رسوب می کند. در دیتا بانک FAF Drugs 3 فیلترهایی موجود اند که با استفاده از آنها می توان این نکته پی برد که اگر وزن یا حجم مولکول زیاد یا کم باشد چه اتفاقی می افتد(سمیت مولکول مورد بررسی قرار می گیرد). اصولا در طراحی دارو از سه محیط برای مطالعه استفاده می شود که عبارت اند از: • In silico: در این محیط مولکول در ابزار های کامپیوتری مورد مطالعه قرار می گیرد • In vitro: مطالعه مولکول در محیط کشت سلولی می باشد.• In vivo: مطالعه مولکول در بدن جانوران مانند موش آزمایشگاهی صورت می گیرد.
بطور کلی تمامی دارو ها به سه دسته تقسیم میشوند: طبیعی ، نیمه صناعی، صناعی
داروهای طبیعی
داروهای طبیعی داروهایی هستند که از منابع طبیعی به دست میآیند. اینگونه فرآوردهها یا به صورت خام مصرف میشوند، مثل عصاره گیاه آلوئه برای درمان بیماریهای پوستی یا جگر برای درمان بیماریهای شب کوری و یا شامل مواد شیمیایی خاصی هستند که از فرآورده خام طبیعی استخراج و سپس به عنوان دارو مصرف میشوند، مثل مورفین که از تریاک استخراج میشود و انسولین که از لوزالمعده گاو یا خوک به دست میآید. در مورد این گروه از داروها، برای کشف داروی جدید به سراغ طب سنتی کشورهای مختلف میروند. در طب سنتی، خواص گیاهان و فرآوردههای مختلف جانوری شرح داده شده است. دانشمندان با روشهای علمی به بررسی آزمایشگاهی خواص ذکر شده در مواد خام میپردازند. این بررسیها ممکن است در شرایط خارج از بدن موجودات زنده (مثل بررسی اثرات ضد میکروبی در محیط های کشت) یا در شرایط داخل بدن (شامل بررسی اثر پس از کاربرد در جانوران آزمایشگاهی) انجام شوند. در صورتی که فرآورده خام، موثر تشخیص داده شود، به روشهای گوناگون ترکیبات مختلف موجود در آن را تفکیک و تخلیص میکنند و سپس میکوشند تا ساختار شیمیایی این ترکیبات خالص شده را (که به دست آوردن مقادیر ناچیزی از آنها اغلب مستلزم ساعتها کار طاقت فرساست) شناسایی کنند.
داروهای نیمه صناعی
داروهای نیمه صناعی با ایجاد تغییرات شیمیایی بر داروهای طبیعی به دست میآیند. این تغییرات با هدف افزایش قدرت دارو، کاهش عوارض جانبی، بهبود خواص فیزیکی و شیمیایی و … انجام میشوند. گاه داوری به دست آمده از منابع طبیعی دارای نقایصی است که با انجام تغییرات جزئی روی ساختار شیمیایی آن میتوان نقص موجود را برطرف کرد. مثلا پنیسیلین حاصل از قارچ پنیسیلیوم در اسید معده تخریب میشود و نمیتوان آن را به صورت خوراکی مصرف کرد، ولی با انجام تغییراتی کوچک در گروههای جانبی هسته پنیسیلین، داروهای پادزی آموکسیسیلین، آمپیسیلین و پنیسیلین V بدست میآیند که نسبت به محیط اسیدی معده مقاومند و از راه خوراکی به مصرف میرسند.برای دستیابی به داروهای جدید نیمه صناعی باید تغییراتی حساب شده و قاعدهمند روی ساختار شیمیایی ماده طبیعی ایجاد کرد و سپس نتیجه این تغییرات را روی اثر دارو بررسی نمود. اینگونه مطالعات منجر به کشف “رابطه ساختمان و اثر” در یک ماده دارویی میشود. دارویی که از طبیعت به دست میآید، در بدن اثرات مختلفی دارد. برای مثال مورفین نمونه جالبی از این مطلب است. این دارو دارای اثرات ضد درد، تسکین دهنده سرفه، ایجاد یبوست، اعتیادآوری و … میباشد. محققان میکوشند تا با دستکاری در ساختار مورفین داروهایی تهیه کنند که هر یک از اثرات فوق را به تنهایی و بدون دارا بودن خاصیت اعتیاد آوری دارا باشند. در راستای این کوششها داروهای بوپرنورفین با اثر ضد درد عالی و اعتیادآوری اندک، دکسترومتورفان با اثر ضد سرفه و بدون اثر ضد درد و اعتیاد آوری و دیفنوکسیلات با اثر ضد اسهال، بدون اثر ضد سرفه و اعتیاد آوری خیلی جزئی ساخته شدهاند.
آشنایی با طراحی دارو به روش کامپیوتر
در حال حاضر طراحی دارو به کمک کامپیوتر به عنوان یکی از ابزارهای بسیار مفید برای توسعه منطقی داروها، مورد توجه قرار گرفته است که در واقع شامل طراحی دارو از روی ساختار بوده و توانسته زمان لازم برای شناسایی و طراحی ترکیبات دارویی، نوع آنها و بهینهسازی ساختارشان را به حداقل زمان برساند. این روش در طی20سال توسعه و تکامل پیدا کرده و به یکی از شاخههای علمی مهم در شیمی دارویی تبدیل شده است.
روشهای طراحی دارو با کامپیوتر را میتوان به سه دسته متفاوت تقسیم کرد که همه آنها بر اساس لیگاند و گیرنده میباشد
1- روش مبتنی بر گیرنده (Dock Receptor Based Approach)
2- روش مبتنی بر لیگاند (Ligand Based Approach)
De Novo Design Based Approach -3
1_روش مبتنی برگیرندهdock receptor based approach
هنگامی که ساختار سه بعدی لیگاند وگیرنده معلوم است، روش مبتنی برگیرنده کاندید خوبی برای شناسایی و یا بهینه کردن داروهاست بخاطر حضور ساختارهای سه بعدی ترکیبات و گیرنده ماهیت برهمکنش بین لیگانده و گیرنده و از طرفی نوع ساختاری که لیگاند میتواند داشته باشد تا برهمکنش بین آنها درشرایط مطلوبی قرار بگیرد را میتوان با استفاده از این روش تشخیص داد. ترکیب بر روی جایگاه فعال داک شده (دراصطلاح به معنی لنگراندازی است) و برهمکنش لیگاند با رسپتور بوسیله مکانیک مولکولی و دینامیک مولکولی شبیه سازی میشود دراین روش براثر داک شدن لیگاند در جایگاه فعال لیگاند از لحاظ کنفورماسیونی تغییر پیدا میکند و در شرایط مختلف وضعیتش عوض میشود و در انواع حالات مختلف باگیرنده برهمکنش نشان میدهد برای تعیین نوع لیگاندهایی که میتواند به جایگاه گیرنده داک شوند تطابق شکل و نیز مکمل بودن قسمتهای آب گریز آب دوست و باردار در هردو باید در نظر گرفته شوند از نرم افزارهای مختلفی مانندautodock برای طراحی دارو و براساس ساختار گیرنده استفاده میشود.
2_روش مبتنی برلیگاندligand based approach
وقتی که ساختارهای سه بعدی گیرنده مشخص نیست و درعوض ساختار لیگاندها معلوم است از این روش استفاده میشود که از جمله روشهای مرسوم میباشد. دراین روش بطور غیرمستقیم با مطالعه ترکیباتی که با مولکولهای زیستی واکنش نشان میدهند به دنبال طراحی ترکیباتی هستند که از لحاظ فارماکولوژیکی فعال باشند. در روشهای طراحی دارو مبتنی برلیگاند در فقدان ساختار مولکولهای زیستی با مطالعه لیگاندهای مشخص به دنبال شناخت ویژگیهای ساختاری و فیزیکوشیمیایی ترکیبات بوده تا بتوان ترکیب مورد نظر را براساس دادههایی که از مطالعه ترکیبات قبلی استخراج میشود طراحی نمود این روش به نوعی طراحی دارو بر اساس فارماکافور است و به وسیله مطالعه روابط کمی ساختار با فعالیت آنها میتوان داروها را به وسیله این روش طراحی نمود به طوری که میتوان گفت روشی برای طراحی فارماکوفور داروهاست.
3_de novo design based approach
زمانی که ساختار لیگاند مشخص نیست اما ساختار گیرنده معلوم باشد در این روش اطلاعاتی از ساختارهای گیرنده یا شبه گیرندهها وجود دارد اما ساختار ترکیب اصلی که بتواند با جایگاه فعال گیرنده برهمکنش داشته باشد وجود ندارد یکی از عملکردهای طراحی دارو بر پایه این روش پیشنهاد و ارایه ترکیب اصلی است که با جایگاه فعال مکمل باشد اساس روش به این صورت است که از پایگاه داده ساختارهای سه بعدی موجود برای پیداکردن مولکولهای کوچکی که بتوانند با جایگاه فعال گیرنده از لحاظ اندازه ژیومتری و گروههای عاملی میانکنش مناسبی داشته باشند استفاده میشود نرم افزارهایی مثل grow : وlegend برای طراحی دارو بوسیله این روش بکار میروند.
Vittual Screening
غربالگري مجازي يك روش محاسباتي مورد استفاده در فرآيند كشف دارو است كه براي جستجوي كتابخانههايي از مولكولهاي كوچك مورد استفاده قرار ميگيرد. هدف از انجام آن شناسايي ساختارهايي است كه با بيشترين احتمال با يك هدف دارويي كه معمولا يك گيرنده پروتئيني يا آنزيم است پيوند تشكيل ميدهند. غربالگري مجازي روشي است كه بطور اتوماتيك كتابخانههاي بسيار بزرگي از تركيبات را با استفاده از برنامههاي كامپيوتري بررسي ميكند. در اين فرايند تعداد بيشماري از تركيبات كه در فضاي شيميايي بعنوان داروي هدف مورد نظر محتمل هستند به تعداد كمي كه قابل سنتز، خريداري يا تست زيستي هستند، كاهش مي يابد.
همزمان با افزايش صحت روشهاي غربالگري مجازي، اين روش به بخش مهمي در فرايند كشف دارو تبديل شده است. غربالگري مجازي به دو دسته تقسيم ميشود: روشهاي براساس ساختار ليگاند و روشهاي بر اساس ساختار پروتئين هدف.
با داشتن مجموعهاي متنوع از ليگاندهايي كه با يك گيرنده پيوند تشكيل ميدهند، مدلي از گيرنده با توجه به اطلاعات موجود در مجموعه ليگاندها ساخته ميشود. به اين مدلها، مدلهاي فارماكوفوري گفته ميشود. سپس ليگاند كانديد را ميتوان با مدل فارماكوفوري مقايسه نمود تا تعيين شود كه آيا با آن انطباق دارد يا خير. در نتيجه براي پيوند شدن به آن محتمل است يا خير. روش ديگر استفاده از روشهاي آناليز مشابهت شيميايي دو بعدي براي بررسي مجموعه داده اي از مولكولها نسبت به يك يا چند ساختار ليگاند فعال است. روش ديگر متداول بر اساس ساختار ليگاند بر مبناي جستجوي مولكولهايي با شكل مشابه نسبت به مولكولهاي فعال شناخته شده است. از آنجايي كه چنين مولكولهايي به سايت پيوندي هدف منطبق ميشوند، مولكولهاي كانديد نيز با هدف دارويي پيوند تشكيل خواهند داد. رايجترين روش انجام غربالگري مجازي بر اساس پروتئين هدف انجام الحاق نمودن است. همچنين روشهاي فارماكوفوري بر اساس ساختار پروتيئن نيز در اين دسته قرار ميگيرند. بنابراين روشهاي غربالگري مجازي را ميتوان به دسته غربالگري مجازي فارماكوفوري، جستجوي مشابهت، و الحاق نمودن تقسيم نمود.
کیوسار در طراحی دارو
در تولید یک دارو، ترکیب پیش رو(Lead) به عنوان مرجعی برای طراحی و سنتز مشتقات مختلفی از داروها به کار می رود. با تغییرات اندک روی گروه های عاملی مختلف که در ترکیب اصلی است می توان شاهد تغییرات شگرف در فعالیت فارماکولوژیکی آن ترکیب شد؛ برای مثال با جابجایی گروه های عاملی مثل متیل، هیدروکسیل، بنزیل و غیره در ساختار ترکیب پیش رو می توان سبب بهبود عملکرد آن شد. یک داروی مؤثر بصورت سیستماتیک از بین هزاران داروی متفاوتی که با استفاده از ترکیب پیش رو طراحی و سپس سنتز شده و کارایی آن بصورت تجربی تحت روش های مختلف و در طی زمان آزموده شده است، مشخص و معلوم می گردد. این فرآیند، به رابطه ساختار با فعالیت (SAR) مرسوم است. SARدر واقع با سنتز و غربالگری ترکیبات مختلف بخش های مفید دارو (از نظر گروه عاملی) را شناسایی می کند.
مدلسازی فارماکوفوری
در طراحی دارو
مدلسازی فارماکوفری بطور گسترده ای در جستجوی مجازی (Virtual screening)، طراحی دی نو وو (De-novo design)، و سایر زمینه ها در شیمی دارویی همچون بهینه سازی ترکیب رهبر (Lead compound) و طراحی چند هدفی (Multitarget design) به کار میروند. از این رو کاربرد گسترده ای در کشف، طراحی و ارائه ترکیبات رهبر جدید در فرآیند ارائه یک ترکیب دارویی جدید دارند.
مفهوم فارماکوفور (Pharmacophore) اولین بار در سال 1909 توسط Ehrlich معرفی شد: فارماکوفر یک چهارچوب مولکولی است که ویژگی های ضروری مسئول ایجاد فعالیت های زیستی یک دارو را حمل میکند. پس از گذشت یک قرن، مفهوم فارماکوفر همچنان بدون تغییر باقی مانده است، اما محدوده کاربرد آن بطور قابل توجهی افزایش یافته است، مطابق با آخرین تعریفی که آیوپاک ارائه نموده است، یک مدل فارماکوفری مجموعهای از ویژگیهای استریک و الکترواستاتیکی است که برهمکنش های بهینه با یک هدف زیستی معین را ایجاد میکنند. میتوان از این تعریف نتایج ذیل را استنباط نمود:
یک فارماکوفر نقاط تعیین کننده الکترونیک و استریک ضروری مورد نیاز برای یک برهمکنش بهینه با هدف دارویی مورد نظر را توصیف مینماید.
یک فارماکوفر ارائه دهنده یک مولکول حقیقی یا مجموعهای واقعی از گروههای عاملی نیست، اما یک مفهوم انتزاعی است که ظرفیت برهمکنش مولکولی مشترک گروهی از ترکیبات را نسبت به سایت پیوندی یک ساختار هدف نشان میدهد.
تصویر ذیل یک مدل فارماکوفر را همراه با سه نوع از ویژگی های شیمیایی و موقعیت استقرار فضایی سه بعدی آنها نسبت به هم را نشان میدهد.
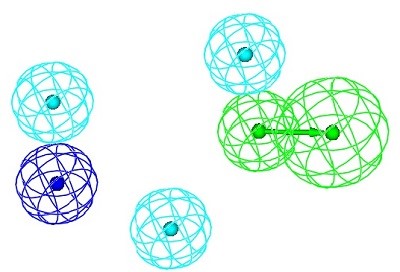
که این مدل فارماکوفر از یک پذیرنده پیوند هیدروژنی ( سبز رنگ )، سه مرکز آب گریز ( آبی روشن )، و یک مرکز قابل یونیزه شدن منفی ( آبی تیره ) تشکیل شده است.
یک مدل فارماکوفری اطلاعات مفیدی را در اختیار یک شیمیدان دارویی قرار میدهد تا ارتباط ساختار را با فعالیت بررسی نماید. علت آن است که مدل فارماکوفری طبیعت گروههای شرکت کننده در برهمکنشهای لیگاند و هدف و نیز نوع فواصل بین بارها و پیوندهای غیر کوولانسی را توصیف مینماید.
یک مدل فارماکوفری را میتوان به روش لیگاند محور، از طریق تراز نمودن (alignment) مجموعهای از مولکولهای فعال روی هم و بدست آوردن ویژگیهای مشترکی که برای فعالیت زیستی آنها ضروری هستند، یا ساختار محور، از طریق جستجوی نقاط برهمکنش ممکن بین هدف بزرگ مولکولی و لیگاند ها بدست آورد.
مدلسازی فارماکوفری لیگاند محور به یک استراژی محاسباتی کلیدی برای کشف دارو در غیاب هدف بزرگ مولکول تبدیل شده است. این روش معمولاً از طریق استخراج ویژگیهای شیمیایی مشترک از ساختارهای سه بعدی مجموعهای از لیگاندهای شناخته شده که برهمکنش های ضروری بین لیگاندها و هدف بزرگ مولکولی خاص را ارائه میدهند انجام میشود.
طی دهه گذشته، به دنبال افزایش دسترسی به ساختارهای تجربی هدفهای بزرگ مولکول روشهای ساختار- محور ( که روشهای هدف – محور یا روشهای مستقیم نیز نامیده میشوند) بسیار مورد توجه قرار گرفتهاند. اطلاعات مربوط به ساختار هدف را میتوان از مدل سازی همولوژی نیز به دست آورد، که امروزه بزرگترین مجموعه داده ساختارهای X-ray و NMR پروتئینها و کمپلکسهای پروتئین – لیگاند، بانک اطلاعات پروتئین است.
این مدل سازی مستقیماً با ساختار سه بعدی یک هدف بزرگ مولکول یا یک کمپلکس لیگاند -بزرگ مولکول کار میکند. مدل سازی فارماکوفری ساختار محور ویژگیهای شیمیایی سایت فعال و ارتباطات فضایی آنها را آنالیز میکند.
می توان از مدل فارماکوفری که از طریق روشهای لیگاند محور یا ماکرومولکول محور تولید شده است برای جستجوی مجموعه دادههای شیمیایی سه بعدی استفاده نمود که از این طریق میتوان لیگاندهای فعال احتمالی را مورد شناسایی قرار داد، به این روش جستجوی مجازی بر مبنای فارماکوفر میگویند. در حال حاضر این روش و روش جستجوی بر مبنای الحاق نمودنروش جستجوی بر مبنای فارماکوفر با مسئله عدم توجه کافی به انعطاف پذیری پروتئین یا عدم استفاده از توابع نمره دهی (Scoring functions)بهینه مواجه نیست، علت آن است که در هر مدل برای هر ویژگی فارماکوفری محدوده ای برای تغییر شعاع کره مربوط به ویژگی مورد نظر در نظر گرفته میشود. در روش جستجوی مجازی از طریق فارماکوفر، یک مدل فارماکوفری به عنوان الگو تعیین میشود و هدف از جستجو، یافتن مولکولهایی است که ویژگیهای شیمیایی آنها مشابه با الگوی ساخته شده باشد، اما ممکن است تعداد دیگری از آنها دارای اسکلت مولکولی کاملا جدیدی باشند. جستجو برای یافتن ترکیباتی که با اسکلت متفاوت فعالیت زیستی یکسانی دارند Scaffold hopping نامیده میشود (docking) ابزارهای اصلی جستجوی مجازی هستند. در مقایسه با روش الحاق نمودن روش جستجوی بر مبنای فارماکوفر با مسئله عدم توجه کافی به انعطاف پذیری پروتئین یا عدم استفاده از توابع نمره دهی (Scoring functions)بهینه مواجه نیست، علت آن است که در هر مدل برای هر ویژگی فارماکوفری محدوده ای برای تغییر شعاع کره مربوط به ویژگی مورد نظر در نظر گرفته میشود. در روش جستجوی مجازی از طریق فارماکوفر، یک مدل فارماکوفری به عنوان الگو تعیین میشود و هدف از جستجو، یافتن مولکولهایی است که ویژگیهای شیمیایی آنها مشابه با الگوی ساخته شده باشد، اما ممکن است تعداد دیگری از آنها دارای اسکلت مولکولی کاملا جدیدی باشند. جستجو برای یافتن ترکیباتی که با اسکلت متفاوت فعالیت زیستی یکسانی دارند Scaffold hopping نامیده میشود.




















