تصویربرداری مولکولی
تصویربرداری مولکولی به تصویربرداری که از روشهای بیولوژیکی استفاده می کنند تصویربرداری مولکولی گفته می شود. این تصاویر از آزمایشگاههای تشخیصی بدست می آید. کاربرد آن در تحقیقات برای سادگی آزمایشات عملکرد متابولیک الگوهای تظاهرات ژنی یا پرسشهای فارماکولوژیکی در ارگانهای زنده می باشد.
با گشودن رموز ژنوم (مجموعهای از ژنهای سلولهای جنسی) انسانی و با دانستن مراحل پاتولوژیکی در سطح مولکولی – (در راستای پیشرفتهای تکنولوژی) – تصویربرداری با روش تشخیص بیولوژیکی مولکولی ایجاد خواهد شد. به تصویربرداریهای پزشکی که از تکنیکهای بیولوژیکی مولکولی بدست آمده از آزمایشگهاههای تشخیص استفاده میکنند، تصویربرداری مولکولی گفته میشود.
در تشخیص پزشکی روش تصویربرداری پزشکی راه را برای رسیدن به یک پیشرفت مهم در زمینه شناخت بیماریهای وابسته مولکولی هموار میکند. از آن زمان تا به حال همیشه تغییرات در سطح مولکولی بر بازسازی آناتومیکی در تصویربرداریهای کانورژنال (مرسوم) پیش است و روشهای تصویربرداری بیولوژیکی مولکولی قادر به تشخیص سریعتر مرحله یک بیماری است.
در این مقالهdriving forces (نیروهای محرک) تصویربرداری مولکولی مختصراً شرح داده میشود و یک تأثیر از پتانسیل این روشها را بیان میکند.
تصویربرداری مولکولی چیست؟
تصویربرداری مولکولی را میتوان هنگام اندازهگیریin vivo و توصیف مراحل بیولوژیکی در سطح سلولی مولکولی تعریف کرد. در مقایسه با روش تصویربرداری تشخیصی کانورژنال این روش ابنرمالیهای مولکولی مهم را که در زمینه بیماری قرار دارد را به جای نشان دادن تأثیر یا شناسایی آناتومیکی تغییر ملکولی نشان میدهد. اصولاً تصویربرداری مولکولی بر تکنیکهای بیولوژیکی (مولکولی) بنیادی یکسان که دههها در تشخیصهایinvitro استفاده میشود، بنا شده است. به خصوص تکنولوژیهای آنتی بادی و پپتید شیمیایی. پارامترهای سلولی آشکار شده همانند گیرندهای(receptor) سطح سلول و فعالیتهای آنزیمی همچنین میتوانند یکسان باشند.
بنابراین جنبههای توکسیکولوژی یاسدهای انتقال آناتومیکی مانندسدعروقی مغزیBBB) ( در تشخیصهای آزمایشگاهی اهمیت ندارند، سازگاری زیستی و انتقال مستقیم به بخش هدف یا سلول هدف از فاکتورهای قطعی بر موفقیت کلینیکی یک عامل کنتراست (بیولوژیکی مولکولی) هستند.
عناصر کلیدی زیر برای تصویربرداری مولکولی مورد نیاز است:
i. عامل کنتراست طراحی شده برای نشان دادن مولکول خواسته شده. ( برای مهمترین قسمت ماکرومولکولهای بیولوژیکی وجود دارد.)
ii. یک مکانیسم تقویت کننده
iii. و یک وسیله تصویربرداری مناسب
برای آشکار ساختن تومورها از عامل کنتراست استفاده میشود. به عنوان مثال: آنتیبادیهایی که به طور انتخابی، باسطح نشاندار یک سلول بدخیم باند میشوند. در این موارد، استفاده از مشتقات آنتیبادی ساخته شده ژنتیکی در مقایسه با آنتیبادیهای طبیعی ترجیح دارد که مقاومت(tolerance)و فارماکوکنیتک را بهبود بخشیده است.
اگر عامل کنتراست با یک نشانگر مانند رادیونوکلئیدها و رنگهای فلورسنت برای به تصویر کشیدن همراه شود، میتوان مستقیماً با یک آشکارساز خوب و مناسب تصویر را ثبت کرد. از زمانی که مجموعه مولکولهای هدف تنها در محدوده پیکومولار تا نانومولار قرار میگیرد، غالباً روشهای تصویربرداری پزشکی هستهای مناسب هستند. در روشهای تصویربرداری با حساسیت پایین مانندMRI باید از مکانیسمهای تقویت سیگنال اضافی استفاده شود. چنین مکانیسمهایی بر روی حیوانات آزمایش شده و در کتابها توضیح داده شدهاند. اصولاً این مکانیسمها شامل ژنتراپی (ژندرمانی) میشود که روشهایی هستند که بر اساس عملکرد DNAخارجی هستند.
نیروهای هدایت کننده (محرک) تصویربرداری مولکولیdriving forces
تکنولوژی اطلاعات، میکروالکترونها و ارزش بهینهسازی شدیداً تصویربرداری پزشکی را متأثر میکند. هدایتگرهای خاص تصویربرداری مولکولی شامل تحقیق علوم زیستی پایه میشود که تحقیق و توسعه فارماکولوژی (داروشناسی) و مفهوم ترانوسیتکtheranostic و ژندرمانی است. این فاکتورها در جزئیات مهمتر آنچه دنبال میگردد، آزمایش خواهد شد.
تصویربرداری مولکولی در تحقیق علوم زیستی پایه و توسعه داروسازی
تحقیق و توسعه فارماکولوژیکی بر تحقیقات پرخطر و پر هزینه بنا شده است. میزان موفقیت اسکرینیگ مرکب پیش کلینیکی کمتر از ۱۰% است. ۹۰% داروهای انتخابی دیگر در طول آزمایشات انسانی بعد کلینیکی رد میشود.
برای آزمایشات اولیه بر روی انسانها که به طور متوسط برای هر داروی تصویب شده جدید ۵۰۰ میلیون دلار را در بر میگیرد، هزینه ایجاد میگردد. در نتیجه افزایش تقاضا برای تحقیق در زمینه طرحهای تحقیقاتی آینده ژنوم انسانی، قیمتها حتی بالاتر خواهند رفت.
طبق مطالعات برنامهریزی شدهMckinsey پیشبینی شده که هزینه (بودجه)D وR یک شرکت داروسازی بزرگ معروف دو برابر میشود یعنی از ۶/۱ بیلیون دلار به ۲/۳بیلیون دلار تا سال ۲۰۰۵ میرسد. در واقع فشارهای قیمت نسبتاً زیاد به مجوز مدت مصرف دارو و رقابت بین تولیدکنندههای داروهای ژنریک بستگی دارد.
مطابقMckinsey نوآوریهای تکنولوژی ممکن است بتوانند که قیمتهای Dو Rرا تا ۶/۲بیلیون دلار در سال ۲۰۰۵ محدود کنند. در حال حاضر مهمترین امکان پیشرفت که بررسی شده، افزایشthroughput آزمایشات مرکب زودرس به طریق
HTS (high throughput screeing) است.
وقتی که داروهای مشتق شده از ژنوم انسانی کشف نشدهاند، اهمیت اعتبار داروهای بیولوژیکی در آینده افزایش خواهند یافت. آخرین برآوردها یک مجموعهای از ۳۰۰۰۰ ژن انسانی را که برای ۱۰۰ هزار بیمار شناسایی شده را فرض میکند. بیشتر از یک دهم بیماران برای اهداف داروهای پتانسیل بررسی شدند. (تنها ۵۰۰ نوع آن بوسیله داروهای اخیر در بازار شناخته شده است.)
هر پروتئین در ارگانیسم بین ۵ تا ۵۰ عملکرد متفاوت دارد. در نتیجه این عملکردهای متعدد و بر همکنشها، شیوه عمل بسیار رایج که بر ژنهای منفرد یا پروتئینها متمرکز شده است برای بهبود درک بیشتر مراحل پاتولوژیک و احتمال ترمیمشان از طریق دارودرمانی مناسب نیست.
کاملاً واضح است که تأثیر داروها در یک سیستم مرکب که ممکن است خودشان را در تأثیر لبه نشان دهند، نمیتوانند در روشهایin vitro تحقیق مورد استفاده قرار گیرند. از آنجا که هدف افزایش میزان موفقیت کلینیکی است لازم است که قبل از آن داروهای انتخاب شده بر روی یک سلول زنده بینقص آزمایش شود و سپس بر روی انسان مورد بررسی قرار بگیرد.
امروزه برای تحقیق در مورد روشهای متابولیکی سلولی مرکب، اغلب سلولها را از بافت جدا میکنند و سپس در محیطin vitro در فلاسکهای رشد پرورش داده میشود.
میزان محدودیتهای سیستمهای مصنوعی از زمانی بیشتر آشکار میشود که سلولهای توسعه یافته با شرایط محیطی تغییر یافته و میزان سهم موجود زنده منطبق گردد. در نتیجه آزمایشهای حیوانی به بسیاری از سئوالات داروسازی پاسخ نخواهد داد و همچنین اهمیت آن زمانی بیشتر خواهد شده که نگرانیهای اخلاقی وجود دارند.
مدلهای حیوانی کوچک هماکنون یک ابزار تحقیق اساسی برای درمانهای جدید معتبر بیولوژیکی را تشکیل میدهند. بنابراین در تحقیقات پایه، مدلهای حیوانی کوچک همانند موشهای از پا درآمده (موشهایی که یک ژن خاص آنها برانگیخته شده است.) لازم است. اگرچه مدلهای حیوانی کوچک هنوز کاملاً از تشخیص دور هستند. مهمترین محدودیت بافت ملکولی که آنالیز شده این است که تنها در حیوانات زنده در یک حساسیت محدود شده ممکن است.
بعنوان مثال، قادر است که اندازههای کینتیک (جنبشی) عملکرد یک دارو را با چندین مقدار اندازه در بیشتر از یک محدوده زمانی خاص بدست آورد، یک تعداد مشابهی از حیوانها باید در پروتکل آزمایشی خاصی درمان شوند. پس از ان حیوانات آزمایشگاهی باید به طور متوالی کشته شوند. در بسیاری از موارد این عمل مطابق یک آنالیزمولکولی با تمام جزئیات انجام میشود. قیمت چنین آزمایشهایی چندان ناچیز نیستند چون موشهای طراحی شده ژنتیکی بسیار گران قیمت هستند.
به علاوه قابلیت تولید و به موجب آن اهمیت آماری یک سری آزمایشان میتواد با تفاوتهای فردی و درونی سازش یابد. در این مورد، تکنیکهایin vitro میتوانند با امکان آنالیزهای ملکولی تکرار شونده یک حیوان منفرد راه حلی فراهم کنند.
در نتیجه تصویربرداری مولکولی با حیوانات کوچک زمانی که با کنترل قیمتهای مربوط به توسعههای پیشکلینیکی همراه شود میتواند به طور اساسی بازده اعتبار بیولوژیکی داروهای انتخابی را بهبود بخشد.
نقش تصویربرداری مولکولی در فرضیه ترانوستیک
ترانوستیک هنگامی که رابطه بسیار نزدیکی بین تشخیص و درمان وجود دارد معنی میشود. هدف ترانوستیک توانایی انجام درمان مناسب برای بیماران خاص در یک زمان صحیح است.
به طور معمول پزشکان تجربی یک بیماری را از روی علائم و نشانههای بیمار تشخیص میدهند و درمان اختصاصی را شروع میکنند. گاهی تستهای آزمایشگاهی و روش تصویربرداری بکار گرفته میشوند، زمانی درمان را موفق میدانند که علائم کمی بعد از دوره درمان ناپدید شود. مدافعان فرضیه ترانوستیک تبدیل سیستم سلامتی را از درمان بیماریها به مراقبتها و خدمات سلامتی پیشبینی میکنند. اساس این دیدگاه حفظ سلامتی است. با فهمیدن این فرضیه که ثبت مراقبتها را در وضعیت سلامتی بیان میکند. تشخیصهای جامعی بدست خواهد آمد که ترجیحاً درمرحله بدون علامت صورت میگیرد. برای تعیین پیشگیریهای ژنتیکی تنها روشهای in vitro(آزمایشگاهی) مانند تکنیک چیپDNA بکار خواهد رفت.
اهمیت نقش تصویربرداری در تشخیصهای زودرس حفظ خواهد شد و توسعه خواهد یافت. از زمانی که تصویربرداری مولکولی قادر به نشان دادن تغییرات در سطح مولکولی است، تشخیص میتواند در مرحله اولیه دوره یک بیماری انجام شود، حتی قبل از اینکه تغییرات مولکولی در شکل ساختار آناتومیکی آشکار شوند. به عنوان مثال، استفاده از تکنیکهای تصویربرداری بیولوژیکی مولکولی امکان تشخیص پاتولوژیهای تومور را بیشتر از ۷ سال زودتر از روشهای رایج فراهم میکند.
به علاوه برنامه درمان و مونیتورینگ درمان در بهبود بیمار مطابق فرضیه ترانوستیک اهمیت بیشتری دارد. اکنون تصویربرداری مولکولی به طور شایعی برای طرحهای درمانی مورد استفاده قرار میگیرد. که به طور کامل در شکل (۱) به منظور رادیوتراپی شرح داده شده است. SPECT/ MRI/ CTتصویر ترکیبی موقعیت و توزیع فضایی فعالیت متابولیکی یک تومور پروستات را برای محاسبه توزیع دوز تابشی نشان میدهد. شکل (۲) نشان میدهد که چطور تصویربرداریdual PET/CT میتواند برای مونیتورینگ درمانی بکار رود.
تصویر یک بیمار ۷۴ ساله را بدون لمیفوماهوجکین قبل و بعد شیمیدرمانی را نشان میدهد. از بین رفتن تومور کاملاً آشکار است. در این مثال از فسفر ۱۸نشاندار شده با دیاکسید گلوکز به عنوان یک ماده کنتراست برای نشان دادن شرایط متابولیکی تومور استفاده میشود.
زوال بدخیمی بوسیله یک مارکر غیر مستقیم بر اساس تغییرات توازن انرژی سلولهای تومور تعیین میشود. در آزمایشات حیوانی عامل کنتراست اخیراً توسعه یافته است به طوری که مستقیماً به پیشنیازهای حیاتی رشد تومور پی بردهاند. آنژیوژنز و آلوپتوز و تهاجم بافتی مورد توجه خاص هستند.
شکل (۳) یک تصویر فلوروسنت را از یک مدل تومور حیوانی کوچک نزدیک باند طول موج مادون قرمز نشان میدهد. در تومور پستانی انسانی را با تهاجم بافتی مختلف به موش پیوند میزنند.
بر طبق متفاوت بودن مقدار تهاجم به موش یک عامل کنتراست فلورسنتی توموری خاص در شرایط غیرفعال تزریق میشود. عامل کنتراست درتوموری که تهاجم بیشتری یافته است بوسیله یک آنزیم، یک پروتئاز که رشد تومور را با درگیر کردن اطراف بافت سالم تسهیل میکند، فعال میشود. عامل کنتراست را میتوان برای آنزیمهای مختلف تهیه کرد. از زمانی که بسیاری از آنزیمها به عنوان اهداف دارویی برای شیمی درمانی انسانی به کار میروند، پیشرفت بسیاری در زمینه طرح درمانی و مونیتورینگ درمانی ایجاد شده است. همچنین تشخیصهای مولکولی برای انجام کلینیکی درمان اختصاصی بیش از پیش به یک داروی خاص مناسب برای یک مجموعه ژنی بیمار خاص نیاز دارد.
اکنون تعدادی از شرکتهای داروسازی فرضیه ترانوستیک را در بازارهایشان بکار میبرند. اولین شرکتی که موجب رواج این نظریه شد شرکت فارمانتیکس بود که از وارفارین استفاده کرد. شرکت دیگری نیز به دنبال آن از روش نشاندار کردن دارو استفاده کرد. مقایسه بازارهای مشترک یا طرحهای تبلیغاتی مشترک در آینده به منظور صنعت عامل کنتراست و سازندگان وسایل قابل تصور است.
تصویربرداری مولکولی در طرح درمان و مونیتورینگ ژن درمانی
امکان مالی و تجربیات پزشکی نظریه ترانوستیک هنوز جای بحث دارد. روش آزمون و خطا آنقدر ادامه خواهد یافت تا به درمانهای مؤثرتر بدون عوارض جانبی برسند. اگرچه بسیار پرخطر و گران قیمت هستند. در چنین مواردی وقتی یک تشخیص با درمان تقریباً متناسب باشند، فاکتور قطعی در جهت بهبود بیمار است. حتی ازدیدگاه مالی افزایش تشخیصها توجیه کننده است.
یکی از درمانهای پرخطر و پرهزینه ژندرمانی است. برای هر درمان خاص با عوارض جانبی حدی باید تاریخچه کلینیکی فردی بیمار با اطلاعات تشخیصی متناسب باشد. به طوری که یک روش تشخیصی کم تهاجمی تصویربرداری مولکولی جایگزینی برای بیوپسی و هیستولوژی (بافت شناسی) است. در زمینه ژندرمانی در آنکولوژی، تصویربرداری خصوصیات محل و آناتومی یک زخم را نشان نمیدهد و همچنین امکان آنالیز مولکولی گیرندهها و خصوصیات ژن را با داشتن اطلاعات بیماران خاص، یک رژیم درمانی در موارد مختلف هر بیماری در شرایط خاص یک بیمار انتخاب شده است. درfollow up (پیگیری) مونیتورینگ ژندرمانی نقش یک تعادل مطابق تصویربرداری مولکولی خواهد بود. عوامل ژندرمانی بر پایه آدنوویروسها به طور شایع در کبد بدون دسترسی بافت هدف به سنگینی انباشته میشود.
عوامل جانبی هپاتوکسیک جدی در برابر تمرکز ناکارآمد عوامل درمانی در بافت هدف، عوامل انباشتگی ژندرمانی و حالت ژن خارجی باید در طول دوره درمان بیان شود.
(چگونگی) مدالیته تصویربرداری مولکولی
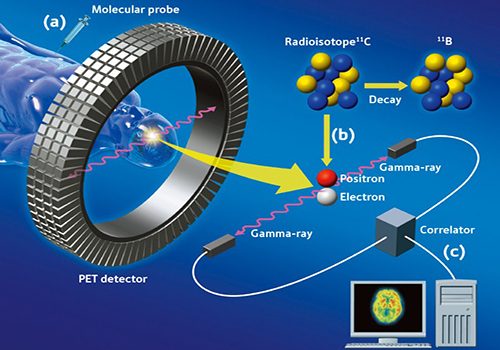
مدالیته تصویربرداری برای تصویربرداری مولکولی شامل تصویربرداری پزشکی هستهای با پرتوداروهای مانند عوامل کنتراست و دوربینهای گاما مانند آشکارسازها(SPECTوPET) توموگرافی تشدید مغناطیسی و تصویربرداریهای نوری مورد توجه است.
روشهای پزشکی هستهای به خاطر حساسیت بالایشان و بدست آوردن تنها مقدار کوچکی از عوامل کنتراست را در محدوده پیکومولار تا نانومولار مناسب هستند. چون واپاشی رادیواکتیو مکانیسم تولید الکترون است، مقداری از نتایج نسبتاً ساده هستند. اگر چه کمیت مشکلتر ایجاد شده است. به وسیله اسکترو تضعیف مقدار در بافت و یکی از عدم مزایای آن قدرت تفکیک فضایی پایین است که مقدار تقریبی آن با وسایلSPECT کلینیکی یک سانتیمتر است و دامنه میلیمتری با دستگاههایPET (High end) مانندECAT EXACT HR بدست میآید.
امروزه حتی فرآیندهای متابولیکی در سطح مولکولی برای استفاده در رادیوداروهای خاص قابل رؤیت شدهاند بوسیلهPET متابولیسم گلوکز با کمک فلوئور نشان داده شد(FDG) و استفاده از مولکول به تصویر کشیده شده است. به عنوان مثال اطلاعاتی که در مورد استفاده SPECTدر شکل ۱ نشان داده شده است. تصویر ۱ یک تومور پروستات را که در هنگام استفاده از سیگنال آنتیبادیهای تککولونیIn نشاندار شده نشان میدهد. اطلاعات مورفولوژیکی و آناتومیکی این تصویر از طریق یک تصویرCT (استخوان) و یکMRI (پروستات) بدست میآید. تصویر نهایی از سوپراپمیوز شدن این دو تصویر با تکنیک ترکیبی بدست میآید.
مزیت عمده توموگرافی تشدید مغناطیسیMR tomography این است که به طور همزمان اطلاعاتی در مورد مورفولوژی و هم در مورد عملکرد فراهم میکند. در یک زمان یکسان قدرت تفکیک فضایی بیشتری بدست میآید. اگرچه در مقایسه با روشهای تشخیص هستهای، (در دامنههای میلیمولار) برای تولید سیگنالی با قدرت کافی به طور قابل ملاحظهای به مقدار بیشتری از عوامل کنتراست نیاز است. با افزایش نسبت سینگنال به نویز و قدرت تفکیک فضایی، تکنیکهای اندازهگیری مانند انتقال به نیروی دامنه اصلی بالاتر و بهبود دامنههای گرادیان قویتر ضروری هستند. اگرچه هر دو تنها در حد محدودی امکانپذیر هستند.
MRIیک بستگی محکم قدیمی با روشهای مولکولی در شکلMRI اسپکتروسکوپی داشته است. در اسپکتروسکوپی سلولهای خاصی که در متابولیسم جدا میشوند، مورد ارزیابی واقع میگردد. اگرچه قدرت تفکیک فضایی بدست آمده با اندازههایvoxel تقریباً ۲ تا ۱ محدود میشود.
هنگامی کهMRI نسبتاً غیرحساس است و چگالیهای عوامل کنتراست بدست آمده بالاست، تصویربرداری مولکولی باMRI تنها به تدریج وارد بخشهای کلینیکی خواهد شد. از این رو روشهای بسیار جالبی برای مکانیسم تقویت سیگنال وجود دارد که بوسیله متابولیسم وMRI مولکولی دارای پتانسیل مهم فعال شده است.
تصویربرداری نوری با عوامل کنتراست فلورسنت روش جالب دیگری را برای جستجوی پردازشهای مولکولی مانند آنچه در بالا شرح داده شد (شکل ۳) نشان میدهد. این روش این امتیاز را دارد که جذب و خاصیت اتوفلورسنتی بافت درنزدیک باند مادون قرمز (طول موجهای بین ۷۰۰ تا ۱۰۰۰ نانومتر) نسبتاً کم است. اگرچه انتشار نور در بافت مانع قدرت تفکیک فضایی بالا میشود. در نتیجه روشهای متعدد تصویربرداری نوری موفقتر خواهند بود. در هر نسبتی تصویربرداری نوری یک اسپکتروم عریض از امکانات کاربردی شامل دامنهای کاربردهای سطحی تصویربرداریهای فانکشنال حین جراحی تا تصویربرداریهای اندوسکوپیک حفره داخل بدن معرفی میکند.
خلاصه اینکه تصویربرداری مولکولی بر روی تصویربرداری تأثیرگذار خواهد بود. نمایش ژنوم انسانی بیولوژی مولکولی به طور قابل ملاحظهای بر میزان رشد اخیر آزمایشگاههای تشخیصی مؤثر بوده است. از دیدگاه بسیاری از کارشناسان، روشهای تشخیصی جدید دوره جدیدی را مانند DNA-chip دوره جدیدی را در صنعت تشخیص ایجاد خواهد کرد. از زمانی که میزان تشخیصهایinvivo وinvitro در دامنه تک رقمی پایین برآورد میشود، میزان پیشرفت زیرمجموعههای آزمایشهای بیولوژی مولکولی invitro بالغ بر ۲۰% است. ما معتقدیم که این پیشرفت را میتوانیم در تصویربرداری هم داشته باشیم و این تنها زمانی امکان پذیر است که تکنیکهای بیولوژی مولکولی از تشخیصهای invitro که نیازهای خاص تصویربرداری تشخیصی هماهنگ است کمک بگیرد. ابزارهای موجود با نیازهای تصویربرداری مولکولی که لازم است تنظیم شده است و پروتکلهای هماهنگ ایجاد گشته است. اگر نیازهای مورد نظر مرتفع گردد، تصویربرداری مولکولی بعنوان یک مکمل در خدمت به دیگر روشهای تصویربرداری و روشهای تشخیصی خواهد بود که قادر به تشخیصهای سریعتر و مخصوصتر باشند و به پزشک برای فراهم کردن درمان مناسبی که با سوابق کلینیکی هر بیمار مطابقت دارد کمک میکند. اکنون پیشرفتهای دلگرمکنندهای در تحقیقات حیوانی به وجود آمده است. سرانجام به نقل از یک آنکولوژیست معروف بنام Michael Oreilly تصویربرداری مولکولی به خوبی کاربرد دارد.




















