
پزشکی هسته ای
تاریخچه پزشکی هسته ای
یكی از روش های تشخیصی- درمانی ارزشمند در طب، پزشكی هسته ای می باشد. این شاخه از پزشکی، در سال ۱۸۹۵ با كشف اشعه X و در سال ۱۹۳۴ با كشف مواد رادیواكتیو آغاز گردید. اولین استفاده كلینیكی مواد رادیواكتیو، در سال ۱۹۳۷ جهت درمان لوسمی در دانشگاه كالیفرنیا در بروكلی بود. بعد از آن در سال ۱۹۴۶ با استفاده از این مواد توانستند در یك بیمار مبتلا به سرطان تیروئید از پیشرفت این بیماری جلوگیری كنند.
تا سال ۱۹۵۰ كاربرد كلینیكی مواد رادیواكتیو رواج نیافت. طی سال های بعد از آن متخصصین و فیزیكدانان به این واقعیت پی بردند كه می توان از تجمع رادیو داروها در ارگان هدف، تصاویری از آن تهیه نمود و یا به درمان بافت آسیب دیده كمك کرد. به طوری كه در اواسط دهه ۶۰، مطالعات بسیاری در زمینه طراحی تجهیزات لازم برای این هدف، آغاز گردید. در دهه ۱۹۷۰ توانستند با روش جاروب نمودن از ارگان های دیگر بدن مانند كبد و طحال، تومورهای مغزی و مجاری گوارشی تصاویری را تهیه کنند. در دهه ۱۹۸۰ از رادیو داروها جهت تشخیص بیماری های قلبی استفاده شد و هم اكنون نیز از پزشكی هسته ای با اطمینان بسیار بالایی، در درمان، تشخیص و پیگیری روند درمان بیماری ها استفاده می گردد. وقایع مهم و مؤثر بر رشد پزشكی هسته ای در ادامه آورده شده است.
۱۸۹۶ :هنری بكرل (Henri Becquerel)اشعه ساطع شده از اورانیوم را كشف كرد.
۱۸۹۷ :ماری كوری (Marie Curie) این تابش را رادیواكتیویته نامید.
۱۹۰۱ :هنری الكساندر دانلوس (Henri Alexander Danlos) و یوگن بلاچ(Eugene Bloch) ، رادیوم را در تماس با ناراحتی پوستی توبركولوز قرار دادند.
۱۹۰۳ :الكساندر گراهامبل (Alexander Graham Bell) جایگذاری منبع اورانیوم در داخل و یا نزدیكی بافت تومورال را پیشنهاد کرد.
۱۹۱۳ :فردریك پروسچر (Frederick Proescher) برای اولین بار مطالعه درمان بیماری های مختلف را توسط تزریق وریدی اورانیوم بنیان نهاد.
۱۹۲۴ :جرج هوسی (Georg Hevesy)، كریستینسن (Christiansen)و لومهولت (Lomholt)، اولین ردیاب رادیواكتیو را بر روی حیوانات آزمایش نمودند.
۱۹۳۶ :جان لارنس (John Lawrence)، اولین كاربرد كلینیكی رادیونوكلوئیدهای خاص را در درمان لوسمی بنیان نهاد.
۱۹۴۰ :راكفلر (Rockefeller) اولین سیكلوترون را جهت تولید رادیوایزوتوپ های ویژه پزشكی در دانشگاه واشنگتن اختصاص داد.
۱۹۴۶ :ساموئل سدلین (Samuel Seidlin)، لئو مارینلی (Leo Marinelli)و الینور اشری (Eleanor Oshry)، یك بیمار با سرطان تیروئید را با I-131 درمان كردند.
۱۹۴۷ :بندیكت كاسن (Benedict Cassen)یُد رادیواكتیو را جهت تشخیص و افتراق ندول های بدخیم و خوش خیم تیروئید بكار برد.
۱۹۵۱ :سازمان دارو و غذای آمریكا (FDA) استفاده از I-131 را برای بیماری های تیروئید تأیید کرد. این اولین مصوبه FDA در رابطه با رادیو ایزوتوپ ها بود.
۱۹۵۴ :دیوید كول (David Kuhl)یك سیستم ثبت فوتونی را برای اسكن رادیونوكلئیدها اختراع كرد. این پیشرفت، پزشكی هسته ای را هم جهت با رادیولوژی به سمت پیشرفت های بیشتر هدایت نمود.
۱۹۶۲ :دیوید كول (David Kuhl) بازسازی تصاویر توموگرافی نشر شده را ابداع نمود. بعدها این روش SPECT/PET نام گرفت. تعمیم این روش در رادیولوژی همان CT می باشد.
۱۹۶۳ : FDA تنظیم ملزومات و قوانین داروهای جدید مرتبط با رادیو داروها را به سازمان انرژی اتمی واگذار کرد.
۱۹۷۰ : FDA اعلام نمود كه با توجه به كاربردهای این مواد، رادیو داروها را می توان با عنوان دارو خطاب کرد.
۱۹۷۱ :سازمان پزشكی آمریكا، پزشكی هسته ای را به عنوان یكی از شاخه های طب، به رسمیت شناخت.
۱۹۷۳ :ویلیام استراس (William Strauss)، تست ورزش را به عنوان اسكن میوكارد معرفی کرد.
۱۹۷۶ :جان كیز (John Keyes)اولین دوربین SPECT را طراحی نمود و رونالد جازاك اولین هد دوربین SPECT را طراحی كرد.
۱۹۸۱ :مچ(Mach) از مواد رادیواكتیو جهت تصویربرداری از تومورها استفاده کرد.
۱۹۸۲ :استیو لارسون (Steve Larson) و جف كاراسكوایلو (Jeff Carrasquillo)بیماران سرطانی ملانومای بدخیم را تحت درمان قرار دادند.
۱۹۸۹ : FDA اولین رادیو داروی پوزیترون را جهت تصویربرداری پرفیوژن ملانوما تصویب نمود.
۱۹۹۲ : FDA اولین رادیو داروی آنتی بادی را جهت تصویربرداری از تومور تصویب كرد.
تاریخچه پزشکی هسته ای در ایران
استفاده از مواد پرتوزا در پزشکی در ایران با سنجش مقدار یُد رادیواکتیو در سال ۱۳۳۹به وسیله یک شمارشگر گایگر در آزمایشگاه پیمان مرکزی دانشکده علوم پزشکی تهران آغاز گردید. در این راستا، یک کارشناس بریتانیایی به نام Malcolm Cuthbert Nokes سهم بزرگی در پیشرفت کار پزشکی هستهای در ایران ایفا کرد. با یاری وی، دکتر نظام مافی
برای اولین بار در سال ۱۳۴۰ با یک پویشگر تیروئید، تحقیقاتی را به انجام رسانید و پایههای پزشکی هستهای را در ایران بنا نهاد . در سال ۱۳۴۶، مرکز پزشکی هسته ای و تحقیقات غدد مترشحه داخلی دانشگاه تهران تاسیس شد که در واقع اولین و قدیمی ترین مرکز پزشکی هستهای کشور محسوب میشود. امکانات این بخش در آن زمان در حد یک دستگاه دوربین انگر بود که تدریجاً مجهزتر گردید.
چشمه های رادیواکتیو برای پزشکی هسته ای
سودمندترین رادیو ایزوتوپها در پزشکی هسته ای رادیوایزوتوپهای تابش کننده گاما می باشند ،زیرا پرتوهای تابش شده از این مواد در درون بدن را می توان از بیرون بدن به سادگی تشخیص داد.اندازه های کاربردی مواد رادیواکتیو در روشهای تشخیص از دید جرم بسیار اندک است (نزدیک به میکروگرم) به گونه ای که این مواد بر روندکارهای فیزیولوژیک بدن اثری ندارند.رادیوایزوتوپها بیشتر به گونه ترکیبی ، وارد بدن می شوند. ترکیب های یاد شده مولکولهای نشاندار هستند.
یک مولکول نشاندار مولکولی است که یک یا چند اتم آن رادیواکتیو باشد.ترکیبات رادیواکتیو، داروهای رادیواکتیو یا رادیوداروها باید از استانداردهای ویژه خالص بودن شیمیایی و دارویی برخوردار باشد. بیشتر رادیوداروهای پزشکی هسته ای از شرکتهای بازرگانی دارویی که چگونگی ویژگیهای رادیوداروها را کنترل می کنند خریداری می شوند. تنها کاری که پزشک یا کاربر باید انجام دهد بکارگیری جدولی برای تعیین اندازه دگرگون شده این رادیوداروها از زمان آخرین اندازه گیری اکتیویته آنهاست.برای نشاندار کردن مولکولها شماری از رادیوایزوتوپها بکار برده می شود. این رادیوایزوتوپها بیشتر تابش کنندههای گاما و دارای ویژگیهای گوناگون فیزیکی هستند. نمونه این رادیوایزوتوپها رادیوایزوتوپهای ۵۳I , 43Tc , 79Au , 15P , 31Ga و … می باشند که به راههای گوناگون تهیه می شوند. البته باید یادآوری کرد که رادیوایزوتوپهای مناسبی از عنصرهای کلیدی هیدروژن و اکسیژن و کربن وجود ندارد، ولی امروزه با به کارگیری شتابنده هایی مانند سیکلوترون در بیمارستانهای پیشرفته ،برخی از سختی های کار از میان برداشته شده است.
برای نمونه رادیوایزوتوپهایی را در جایگاه مصرف تولید می کنند که نیمه عمر چند دقیقه ای دارند .نمونه این رادیوایزوتوپها Ga , Fe , F , O می باشد. O با نیمه عمر دو دقیقه ای به سرعت جذب بدن می شود و در همین زمان کوتاه می توان بررسیهای دقیق فیزیولوژیک انجام داد. شماری از رادیوایزوتوپهای کاربردی در پزشکی از ژنراتورهایی بدست می آیند که درباره آنها بیشتر گفتگو خواهد شد. رادیوایزوتوپهای مورد استفاده در کارهای تشخیصی باید تابش کننده گاما بوده گاهی پوزیترون بکار می رود و نیمه عمر مناسب کارتشخیصی را داشته باشند.از با ارزش ترین رادیوایزوتوپها در کار تشخیص، Tc است که شمار فراوانی از ترکیب های شیمیایی کاربردی را با آن نشاندار می کنند. تکنسیم بصورت پرتکنتات سدیم ( NaTco12 ) برای نشاندار کردن بکار می رود. درتهیه این مولکولها در آغاز پرتکنتات به یون Tc کاهش داده شده و سپس آنرا با ماده شیمیایی دلخواه بصورت کمپلکس در می آورند. ماده شیمیایی آماده است و تنها باید پرتکنتات بگونه ای استریل و بدون پیروژن به آن افزوده شود
و پس از چند دقیقه ترکیب برای کاربری آماده است. راندمان این فرایند شیمیایی به ۹۰ درصد می رسد و باقیمانده ترکیب نشده به گونه ناخالصی درترکیب وجود خواهد داشت.به علت تابش شدید پرتو در ترکیب ،ترکیب های یاد شده می توانند دی ناتوره شوند از این رو ترکیب بدست آمده باید در همان روز بکار برده شود و اگر اجبار در نگهداری آنها وجود داشته باشد،
باید با افزودن نگهدارنده های مناسب در دمای پایین نگهداری شوند.رادیوایزوتوپهای پرکابرد پزشکی بیشتر از ژنراتورها بدست می آیند. دو رادیوایزوتوپ بسیار پرکاربرد برای کارهای تشخیصی و درمانی رادیوایزوتوپهای Tc و I می باشند. نیمه عمر ۸ روزه I اجازه می دهد که آن را به جاهای دور دست انتقال دهند. این رادیو دارو در درمان سرطان تیروئید و همچنین کنترل پرکاری آن نقش اساسی دارد.تکنیسم با نیمه عمر ۶ ساعته اجازه می دهد که بیشتر کارهای تشخیصی به آسانی انجام پذیرد.
ژنراتورهای مواد رادیواکتیو

در یک ژنراتور یک رادیوایزوتوپ دختر با نیمه عمر کوتاه که کاربرد پزشکی دارد از یک رادیوایزوتوپ مادر که نیمه عمر طولانی دارد به دست می آید. نمونه های این ژنراتورها چنین اند:
Tc (6 hrs)
Mo (67 hrs)
(I( 2.3 hrs
Te ( 78 hrs)
Sr (2.8 hrs)
Y ( 80 hrs)
a ( 67 min)
Ge (271 ds)
Kr ( 13 Sec)
Rb ( 4.6 hrs)
رادیو اکتیویته ها در بافت هدف تجمع می کنند بعضی از رادیو ایزوتوپ ها که بافت هدفشان چند گانه است در اسکن از کل بدن کاربرد دارند.به طور مثال رادیو ایزوتوپ TC-Dtpa در ناحیه ی کلیه و TC_ Dmsa در ناحیه ی کبد تجمع می کنند .وقتی رادیو ایزوتوپ تجویز شد به سه شکل به بیمار داده می شود:
۱ – درون رگ تزریق می کنند ۲ – به صورت خوراکی ۳ – استنشاق
| رادیو نوکلید |
شکل شیمیایی |
کاربرد |
| 99mTc |
پرتکنتات سدیم |
مغز ، تیروئید ، غدد بزاقی ، عکس برداری استخر خونی ، مکان یابی ، جفت جنین |
| 99mTc |
کلوئید آلبومین |
جگر ، طحال ، عکسبرداری مغز استخوان |
| 99mTc |
اتیدرونات EHDP |
عکسبرداری استخوان |
| 99mTc |
پنتتات DTPA |
عکسبرداری مغز ، ریزش کلیوی ، عکسبرداری تنفس شش |
| 99mTc |
پیروفسفات PPi |
عکسبرداری استخوان ، عکسبرداری آرواره |
| 131I |
یدید سدیم |
تشخیص کار تیروئید ، عکسبرداری تیروئید |
| 125I |
آلبومین |
تعیین حجم خون و پلاسما ، بررسیهای تیروئید |
| 123I |
یدید سدیم |
تشخیص کار تیروئید ، عکسبرداری تیروئید |
| 201Tl |
کلرید تالوس |
عضلات قلب ، گردش خون |
| 133Xe |
گاز |
عکسبرداری تنفسی ، مطالعات جریان خون |
| 67Ga |
سیترات گالیم |
عکسبرداری تومور |
آشکارسازی پرتوها در پزشکی هسته ای
دو گونه جداگانه از شمارش در پزشکی هسته ای انجام می گیرد:
الف)جهت تعیین اندازه رادیواکتیویته در نمونه یا حجمی معین
– اتاقک یونش
– آشکار ساز کنترگایگر مولر
ب)جهت تعیین چگونگی پخش رادیواکتیویته در بدن
-دستگاه های نگاره برداری
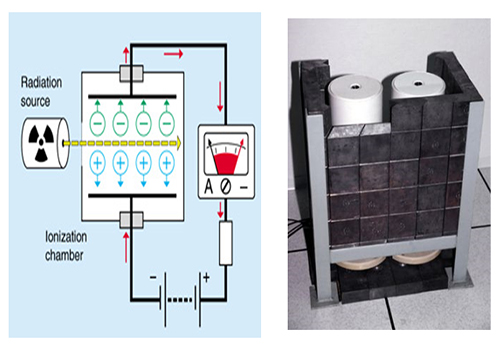
اتاقک یونش
ساختار یک اتاقک یونیزاسیون
اتاقک یونیزاسیون را میتوانیم به صورت یک خازن با صفحات موازی تلقی کنیم که ناحیه بین صفحات آن را گازی که معمولا هواست، پر کرده است. میدان الکتریکی در این ناحیه مانع از ترکیب مجدد یونها و الکترونها میشود و برای درک بهتر وضعیت درون اتاقک باید گفت در حالی که ابری از الکترونها به سوی صفحه متصل به پتانسیل مثبت رانده میشود، یونهای مثبت به طرف صفحه دیگر خازن سوق داده میشود.برای ورود دسته پرتوها به داخل اتاقک ، روی بدنه جانبی اتاقک سوراخی تعبیه شده است و برای اینکه پرتوهای ورودی بتوانند بدون برخورد به مانعی (بجز هوا) از اتاقک خارج بشوند، در مقابل همین سوراخ ، روی بدنه مقابل ، سوراخ وسیعتری ایجاد شده است.
طرز کار اتاقک یونیزاسیون
هنگامی که پرتوها از سوراخ اول وارد و از سوراخ دوم خارج میشوند، در محدوده طول مسیر خود ، حجم مشخصی از هوای درون اتاقک را یونیزه میکنند. الکترونها و یونهای تولید شده تحت تاثیر میدان الکتریکی هر کدام به سمت صفحات مخالف حرکت میکنند تا به آن برسند. با اندازه گیری مقدار بار الکتریکی که به یکی از صفحات رسیده است و با دانستن مقدار حجم هوایی که در آن یون سازی صورت گرفته،
میتوان به کمیت پرتو پی برد. برای اندازه گیری دقیق مقدار پرتوها با این وسیله نکات مهم زیر رعایت میگردد: ابعاد اتاقک طوری انتخاب میشود که پرتوهای یونساز تمام انرژی خودشان را درون اتاقک از دست بدهند و به همین دلیل ابعاد اتاقک تابع انرژی پرتوهاست. با گذاردن مانع کافی در سر راه پرتوها ، بجز آنچه از سوراخ تعبیه شده وارد اتاقک میشود، از ورود بقیه پرتوها جلوگیری میشود.سعی میشود
که بین دو صفحه فلزی و بخصوص در محدودهای که یونها جمعآوری و اندازه گیری میشوند، شدت میدان الکتریکی یکنواخت باشد و به همین سبب است که یکی از صفحات جاذب یونها به سه قسمت تقسیم میشود و فقط یونهایی که در محوطه میانی اتاقک تولید میشوند، جمعآوری و اندازه گیری میشوند. با دخالت دادن ضریبی که مربوط به تاثیر درجه حرارت و فشار در حجم هوای مورد تابش است، نتایج حاصل از اندازه گیریها تصحیح میگردد.
سیستم های دزیمتری با اتاقک یونش
1-اتاقک ها والکترومترها
اتاقک های یونش،درپرتودرمانی وپرتوشناسی تشخیصی برای تعیین دزتابش مورداستفاده قرار می گیرند.تعیین دزدرشرایط پرتودهی مرجع،مدرج سازی باریکه نیز نامیده می شود.اتاقک های یونش بسته به نیازهای خاص به شکل ها واندازه های مختلفی عرضه می شوند،ولی همگی به طورکلی ویژگیهای زیر را دارا هستند:
یک اتاقک یونش اصولاحفره ای پر از گازاست که توسط یک دیواره خارجی فلزی احاطه شده است ودارای یک الکترود مرکزی جمع آوری کننده می باشد.دیواره والکترود جمع آوری کننده توسط یک عایق با کیفیت بالا از یکدیگرجداشده اند،تاهنگامی که یک ولتاژ قطبی کننده براتاقک اعمال می شود،نشت جریان راکاهش دهد.
معمولایک الکترودمحافظ دراتاقک تدارک دیده شده است تا نشتی اتاقک رابیشتر کاهش دهد.الکترودمحافظ باگذشتن ازکنارالکترودجمع آوری کننده باجریان نشتی تلاقی کرده، به آن اجازه میدهد تابه زمین شارش پیداکند.
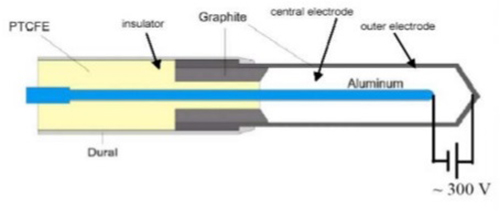
2- اتاقک های یونش استوانه ای(ازنوع انگشتانه ای(
عمومی ترین اتاقک یونش استوانه ای،اتاقک۶/۰۳CM است که به منظور مدرج سازی باریکه درزیمتری پرتو درمانی توسط فارمرطراحی شده وتوسط بالدوین ساخته شده است،ولی اکنون توسط فروشندگان مختلف عرضه می شود.حجم حساس اتاقک آن شبیه انگشتانه است،واز این رواتاقک فارمر،اتاقک انگشتانه ای نیزنامیده میشود. طرح واره ای ازیک اتاقک یونش انگشتانه ای فارمر در شکل زیر نشان داده شده است.

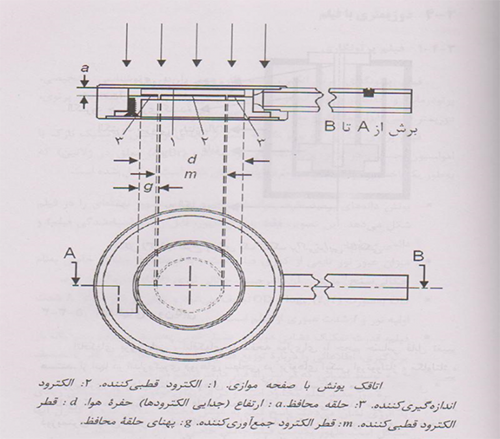
3- اتاقکهای یونش باصفحه موازی
یک اتاقک یونش با صفحه موازی (موازی صفحه ای) ازدو دیواره صفحه ای تشکیل شده است که یکی بصورت پنجره ورودی والکترودقطبی کننده عمل می کند ودیگری بصورت دیواره پشتی والکترودجمع آوری کننده وهمچنین سیستم حلقه محافظ عمل می کند.
دیواره پشتی معمولا قطعه ای ازپلاستیک رسانا یا ماده ای نارسانا(معمولاپرسپکس یاپلی استیرن)با لایه ی رسانای نازکی ازجنس گرافیت برروی سطحش است که الکترود جمع آوری کننده وسیستم حلقه محافظ راشکل می دهد.
طرح واره ای ازیک اتاق یونش با صفحه موازی
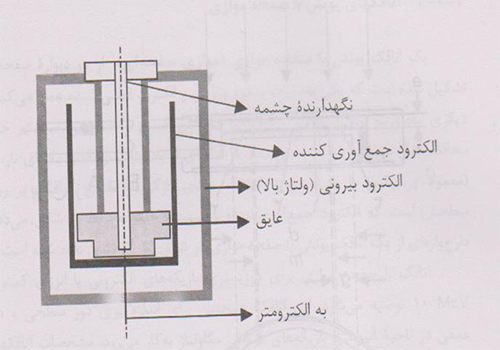
4- اتاقک های براکی تراپی
چشمه های مورداستفاده دربراکی تراپی،چشمه هایی باآهنگ گرمای هوای پائین هستنـــد که به اتاقک های باحجــم کافـــی حدود(۲۵۰cm3یابیشتر)نیاز دارندتاحساسیت مناسبی داشته باشند.اتاقکهای چاهکی یا باقابلیت ورودمجددبطورایده آلــی برای مدرج سازی واستانداردسازی چشمه های براکی تراپی مناسبند.اتاقک های براکی تراپی باید طوری طراحی شوندکه چشمه های دارای ابعادوشکلهای معمول مورداستفاده بالینی دربراکی تراپی رادرخودجای دهندومعمولابرحسب آهنگ مرجع گرمای هوامدرج می شوند.
طرح پایه ای یک اتاقک براکی تراپی
5- اتاقکهای برون یابی
اتاقکهای برون یابی،اتاقکهای باصفحه موازی ای باحجم حساس قابل تغییرهستند.ازآنها دراندازه گیردزهای سطحی درپرتوهایXو مگاولتاژودردزیمتری پرتوهای بتا وایکس کم انرژی استفاده میشود. علاوه براین،هنگامی که مستقیــمادریک فانــتوم معادل بافت قرار می گیرند،میتوان از آنهادردزیمتری مطلـــق،تابش نیزاستفاده کرد. باانجام اندازه گیــریهای بصورت تابعی ازضخامت حفـــره وسپس برون یابی تاضخامت صفر،می توان اثراغتشــاشی حفره رابرای الکترون حذف کرد.بااستفاده ازاین اتاقک می توان اغتشاش حفره رابرای اتاقکهای باصفحه موازی که دارای ضخامت محدودی اند تخمین زد.
آشکار ساز کنترگایگر مولر
آشکارسازها ابزاری هستند که برای سنجش و آشکارسازی شدت و یا طیف یونیزاسیون و یا غیر یونیزاسیون به کار میرود. اساس کار اکثر آشکارسازها مشابه است. متناسب با این که بخواهیم چه نوع ذرهای را آشکار کنیم باید از آشکارسازهای خاصی استفاده کنیم.
آشکارسازهای گازی از جمله مهم ترین و پرکاربردترین آشکارسازها محسوب میشوند. برای اولین بار در سال ۱۹۰۸ آشکارسازهای گازی برای آشکارسازی اشعه توسط گایگر مولر در آزمایشگاه رادرفور استفاده شد و پس از آن برای آشکارسازی و سنجش اشعه مورد استفاده قرار میگیرد. آشکارساز گایگر مولر (G- M) آشکارساز گایگر نیز نامیده میشود. این آشکارساز، شمارندهای برای ذرات بنیادی و ذرات باردار هم چنین برای سنجش اشعه ایکس، گاما، ذرات آلفا و ذرات بتا نیز کاربردهای فراوان دارد. آشکارساز گایگر از جمله آشکارسازهایی است که برای سنجش میزان آلودگی رادیواکتیو نیز استفاده میشود.
تصویر یک آشکارساز گایگر مولر

اساس کار آشکارساز گایگر مولر
مبنای کار بدین صورت است که زمانی که یک پرتو یا ذرهی شتابدار در حجم گاز وارد میشود، یونیزه میشود.اگر اختلاف پتانسیلی بین دو الکترود برقرار باشد، میدان الکتریکی در گاز ایجاد شده و نیرویی از طرف میدان به یونها وارد شده و یونهای مثبت را به الکترود منفی و یونهای منفی را به سمت الکترود مثبت هدایت میکند.
حرکت یونها منجر به تولید جریان الکتریکی لحظهای میشود. جریان تولید شده به وسیلهی یک الکترومتر با حساسیت متوسط قابل اندازه گیری است. شدت جریان تولید شده به عواملی از جمله اختلاف پتانسیل الکترودها، فاصلهی دو الکترود، نوع گاز، حجم گاز، فشار و دمای گاز بستگی دارد که از بین این عوامل اختلاف پتانسیل بین دو الکترود مهم ترین عامل تأثیرگذار در شدت جریان است.
اگر ولتاژی بین دو الکترود برقرار نباشد. یونها در محیط گازی ترکیب شده و اتم یا مولکول خنثی ایجاد شده و جریانی حاصل نمیشود. هر نوع گازی را میتوان در آشکارسازهای گایگر استفاده کرد، البته همان طور که گفته شد نوع گاز نیز در سنجش و آشکارسازی ذرات با ایجاد جریان مۆثر است. هوا و کلر از جمله گازهایی هستند که بهتر است در این آشکارسازها استفاده میشوند.
تصویر اجزاء درونی آشکارساز گایگر مولر

آشکارساز گایگر مولر قادر است حتی با وجود یک زوج یون در محیط گازی جریان و پالس ایجاد کند. بنابراین اگر اشعهای وارد حجم گازی آشکارساز وارد شود حتماً شمرده خواهد شد. پالسهای تشکیل شده توسط این آشکارسازها ارتفاع بیشتری نسبت به بسیاری از انواع دیگری از آشکارسازهای دارند و هم چنین نیازی به استفادهی تقویت کننده در آشکارسازهای گایگر نیست.
دستگاه های نگاره برداری در پزشکی هسته ای
در تشخیص ،آگاهی از چگونگی پخش مواد رادیواکتیو در یک عضو بسیار با ارزش است. نگاره برداری از چگونگی پخش مواد رادیواکتیو دربدن ،امروزه مهمترین کار پزشکی هسته ای است. امروزه نگاره برداری پرشکی هسته ای با بکارگیری آشکارسازهای سوسوزن(سینتیلاسیون)انجام می شود.
آشکارسازهای سنتیلاتور
بعضی از مواد ( مثلا فسفات زنگ ) وقتی در معرض اشعه رادیواکتیو قرار میگیرند از خود نور مرئی ساطع می کنند و چون این نور به صورت جرقه مشاهده میشود لذا آنها را مواد جرقه زن یا سنتیلاتور می نامند .
این پدیده از زمانهای خیلی پیش مشاهده شده بود ولی چون اندازه گیری نور مرئی جزئی که از این مواد ساطع میشود تقریبا غیرممکن بود لذا کسی به این روش اندازه گیری توجه نمی کرد . تا اینکه بعد از پیدایش لوله های فوتو مولتی پلیر توانستند این دو وسیله را با هم استفاده نمایند . اکنون ترکیب این دو وسیله عمده ترین دستگاه اندازه گیری اشعه رادیواکتیو در ازمایشگاه های طب هسته ای می باشند .
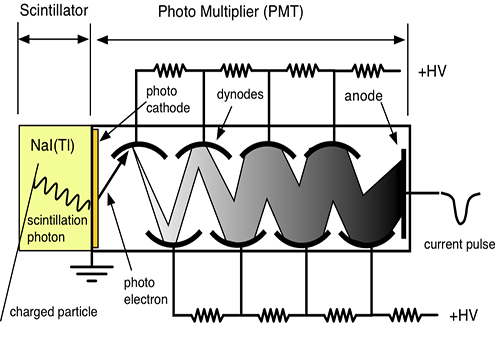
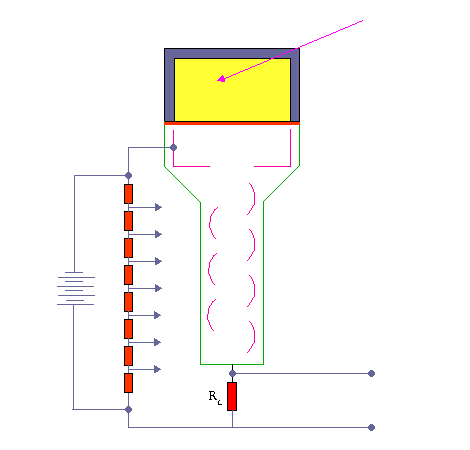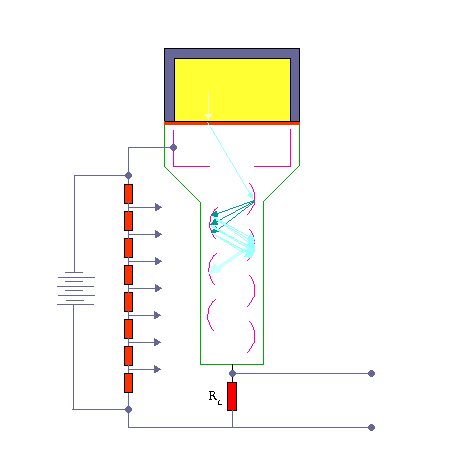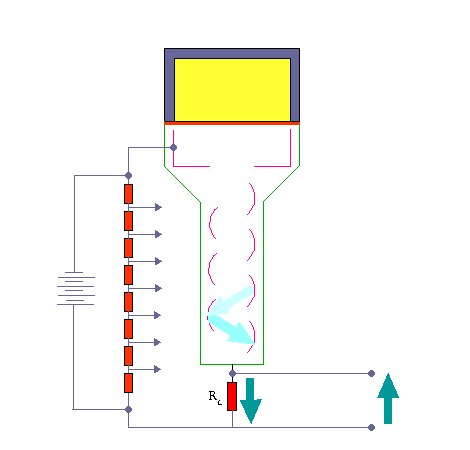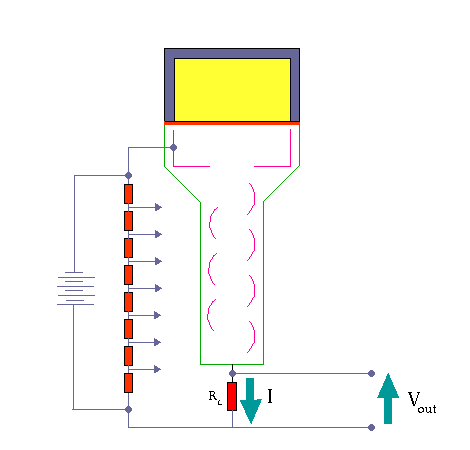
مکانیزم کار شمارنده سنتیلاتور
وقتی که تابش یونیزه کننده از داخل سنتیلاتور عبورمی کند، فوتون هائی را بوجود می آورد. فوتو مولتی پلیر دارای لایه ای با خاصیت فوتو الکتریک می باشد. وقتی نور با این لایه برخورد می کند، الکترون از آن خارج می شود. تعداد الکترون های خارج شده تابع شمار فوتون هائی است که با فوتو کاتد برخورد می کنند. الکترون های گسیل شده توسط سطح فوتو کاتد در میدان الکتریکی شتاب می گیرند و به طرف داینود رانده می شوند.
داینود صفحه ای است با رویه ای خاص که الکترون ها به آسانی از آن کنده می شوند . هر الکترونی که به داینود می رسد بسته به انرژی ای که از میدان الکتریکی کسب می کند ، حدود سه یا چهار الکترون از داینود می کند.سپس الکترون هایی که از داینود گسیل می شوند ، به طرف دومین داینود شتاب می گیرند و هر یک از الکترون ها چندین الکترون دیگر را از این داینود جدا می سازند و این فرآیند چندین بار با تعداد الکترون هایی که در هر داینود سه یا چهار برابر شده اند تکرار می شود
تکثیر کننده های فوتونی موجود ۶ تا ۱۴ مرحله ای هستند . الکترون های آخرین داینود بار کل Q توسط یک صفحه ( که آند نام دارد ) جمع می شوند و از آنجا الکترون ها به طرف خازن جریان پیدا می کنند . در نتیجه در خازن C باری برابر به بار خازن القا می شود که در خروجی ایجاد ولتاژ می کند که این به کمک مدار RC به صورت یک پالس می باشد .
مواد سنتیلاتور
بعضی از مواد می توانند انرژی جذب نموده و مقداری از آن را به صورت نور مجدد تابش نمایند ، این عمل لومینسانس نام دارد .موادی که تابش مجدد را در طول زمانی در حدود چند میکرو ثانیه یا کمتر انجام می دهند ، به مواد فلوئورسان موسوم هستند .موادی که فاصله زمانی جذب انرژی و پس دادن آن به صورت نور برایشان طولانی تر است ، فسفر سان نام دارند . در آشکارسازی تابش ها فقط مواد فلوئورسان بکار می روند . وقتی برای چنین منظوری مورد استفاده قرار می گیرند سنتیلاتور نامیده می شوند .
یکی از خواص لازم برای سنتیلاتور این است که باید به مقدار زیاد نسبت به فوتون هایی که تابش می کنند شفاف باشند . قسمتی از فوتون های که به وسیله سنتیلاتور جذب می گردد ، بستگی به نوع ماده دارد . سنتیلاتور های غیر آلی تقریبا ۱۰۰ درصد شفاف هستند . سنتیلاتور های آلی به طور کلی شفافیت کم دارند .انواع مختلف سنتیلاتور مورد استفاده قرار می گیرند . مواد غیر آلی جامد بیشتر ی دور فلزات قلیایی و مواد جامد آلی ، به مقدار زیاد هیدروکربور های معطر جانشین شده ، محلول های آلی در حلال های مایع و یا پلاستیک از مواد سنتیلاتور هستند .
آشکارسازی اشعه گاما به وسیله ی شمارنده های سنتیلاسیون
اشعه گاما در نتیجه یکی از مراحل زیر در سنتیلاتور متوقف می گردد :
۱ – فتوالکتریک
۲ – پدیده کامپتون
۳ – پدیده تولید جفت
در مرحله اول الکترون ها به وجود می آیند و در مرحله سوم الکترون ها و پوزیترون ها ایجاد می شوند . این ذرات بار دار سنتیلاتور را تحریک کرده و فوتون ها را به وجود می آورند . بنابراین ارتفاع پالس ایجاد شده به وسیله اشعه گاما متناسب با انرژی الکترون و پوزیترون می باشد . می توان نتیجه گرفت که توزیع ارتفاع پالس ( یعنی تعداد پالس ها بر حسب ارتفاع پالس ) تابع سطح مقطع های نسبی در این مرحله است .هر نوع سنتیلاتور را می توان برای آشکار سازی ذرات باردار به کار برد . به عنوان مثال برای ذرات آلفا چون برد آنها خیلی کوچک است ، کریستال های نازک به کار می برند .
در شمارش بتا با سنتیلاتورها باید توجه خاصی به این دو فاکتور شود :
۱ – پراکندگی به عقب
۲ – توزیع انرژی اتصالی برای ذرات بتا از منابع رادیواکتیو
پراکندگی به عقب در مورد سنتیلاتورهای پلاستیک آلی خیلی کوچک است ،لذا این نوع کریستال ها برای اسپکتروسکپی الکترون مورد استفاده قرار می گیرد.




















