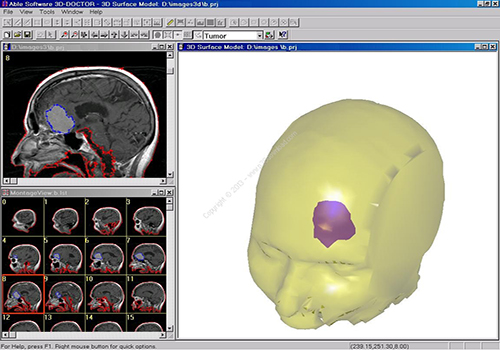
پردازش تصویر در پزشکی
دنياي مدرن امروز اين امكان را فراهم آورده تا تصاوير به صورت ديجيتال دريافت و ذخيره شوند. براي بدست آوردن نتايج بهتر گاهي لازم است تا بر روي اين تصاوير تغييراتي صورت گيرد اين تغييرات سه هدف عمده را دنبال مي كنند: پردازش، آناليز و درك تصوير. به همين دليل سيستم هاي كامپيوتري پردازش تصوير بوجود آمده است تا با سرعت و دقت بهتر بتوان اين اعمال را انجام داد. در اين سيستم ها ۴فرايند عمده اتفاق مي افتد: پيش پردازش، ارتقاء كيفيت تصوير، تبديل تصاوير و طبقه بندي و آناليز تصاوير. در اين روش ها با استفاده از علم رياضيات قواعدي براي شبيه سازي المان هاي بينائي انسان توسط كامپيوتر ايجاد شده است و يك جنبه آناليز تصاوير است كه براي منظورهاي خاصي كاربرد دارد. ديد كامپيوتري (Computer Vision) آناليز تصوير علمي است كه در شاخه هاي مختلف علم مانند پزشكي، مهندسي، تصوير برداري مولكولي، فضانوردي، امنيتي و …. كاربرد دارد.تكنولوژي مدرن ديجيتال اين امكان را فراهم آورده كه سيگنال هاي چند بعدي را توسط سيستم هائي از مدارات ديجيتال ساده گرفته تا چندين كامپيوتر موازي دستكاري كرد.
هدف از اين دستكاري ها يكي از موارد زير است:
-پردازش تصوير:ورودي تصوير / خروجي تصوير
–آناليز تصوير:ورودي تصوير / خروجي شامل تعدادي از اندازه گيري ها
– درك تصوير:ورودي تصوير / خروجي شامل توصيف ادراكي تصوير.
با توجه به اين كه در دنياي امروز بيشتر حس كننده هاي از راه دور اطلاعات خود را به صورت ديجيتال ذخيره مي كنند، نهايتا تمام تفسيرها و آناليز تصاوير نيازمند مقداري پردازش ديجيتال است. پردازش ديجيتالي تصاوير ممكن است شامل انواع مختلفي از پردازش از جمله فرمت و اصلاح داده ها، بهينه سازي ديجيتال به منظور آسان سازي هر چه بيشتر تفسير و تحليل يا حتي طبقه بندي هدف ها و خصوصيات به صورت خودكار توسط كامپيوتر باشد. به منظور انجام اين اعمال لازم است تا داده ها به گونه هاي مناسب براي ذخيره بر روي فضاي فيزيكي موجود باشند.
شايع ترين اعمالپردازشي كه در سيستم هاي آناليز تصاوير استفاده مي شود را مي توان در ۴گروه زير دسته بندي كرد:
- پيش پردازش (Preprocessing)
اين دسته از پردازش ها شامل آن هايي است كه معمولا قبل از آناليز اصلي تصاوير و استخراج اطلاعات لازمند و عموما تحت عنوان تصحيح هاي راديومتريك يا ژئومتريك گروه بندي مي شوند. تصحيح هاي راديومتريك شامل اصلاح داده ها از نظر بي نظمي هاي گيرنده ها و نويز هاي ناخواسته هستند و هدف آن ها بدست آوردن تصوير دقيقي است كه از تابش اشعه به گيرنده ها ايجاد مي شود. تصحيح هاي ژئومتريك به منظور اصلاح اعوجاج هاي تصوير و تبديل آن به مختصات حقيقي بر روي سطح زمين است.
-افزايش كيفيت تصوير (Image Enhancement)
اين دسته از پردازش ها صرفا به منظور بهبود و افزايش وضوح تصوير هستند تا بتوان تفسير بهتري را از تصاوير بدست آورد.
- تبديل تصوير (Image Transformation)
اين اعمال از جهت نظري شبيه گروه قبل است ولي بر خلاف اين گروه كه تنها بر روي يك كانال داده اعمال مي شود، اين گروه شامل پردازش تركيبي بر روي داده هاي بدست آمده از چندين باند طيفي مي شود. اعمال رياضي (جمع، تفريق، ضرب، تقسيم) اعمال مي شوند تا باند هاي اوليه را تركيب كرده و آن ها را به تصاوير جديدي كه وضوح بيشتري داشته و يا خصوصيات ويژه اي را بهتر نمايان مي كنند تبديل نمايد.
- طبقه بندي و آناليز تصوير
هدف از اعمال اين بخش از پردازش ها، طبقه بندي و مشخص سازي پيكسل ها در داده است. طبقه بندي معمولا بر روي گروه هاي داده چند كانالي اعمال مي شود و اين عمل هر پيكسل تصوير را بر اساس خصوصيات آماري مقادير روشنائي آن ها به يك گروه يا تم اختصاص مي دهد. براي انجام اين پردازش دو روش عمده، با سرپرست و بدون سرپرست وجود دارد.(دوره تعمیرات تجهیزات دندانپزشکی)
تعاريف
تعريف تصوير در دنياي واقعي شامل تابعي از دو متغير حقيقي است مثل I(x,y) كه در آن I شدت تصوير (مثلا ميزان روشنائي) در مكان حقيقي (x,y) است. يك تصوير ممكن است شامل تعدادي زير تصوير باشد كه گاهي به آنها نواحي مورد توجه (Regions-Of-Interest) يا (ROI)و يا نواحي گفته مي شود. اين نظريه مشخص مي كند كه تصاوير معمولا شامل مجموعه هائي از اشياء است كه هر كدام پايه يك ناحيه را تشكيل مي دهد. در يك سيستم پردازش تصوير مناسب بايد بتوان روي نواحي مختلف اعمال متفاوتي انجام داد مثلا در يك ناحيه تاري ناشي از حركت را كاهش داد و در همان زمان در ناحيه ديگر كيفيت رنگ را تغيير داد.
شدت ها در تصاوير يا به صورت اعداد حقيقي و يا به صورت اعداد صحيح است. حالت دوم ناشي از Quantization است كه شدت ها را از حالت پيوسته به حالت مجزا تبديل مي كند. در برخي فرايندهاي تشكيل تصوير از شمارش فوتون استفاده مي شود كه در اين صورتquantization به طور ذاتي در فرايند وجود دارد. در برخي تصوير برداري ها مانند MRIاعداد به صورت حقيقي است. مورفومتري به معناي توضيح كمي يك ساختار است.استريولوژي در واقع استخراج و تفسير اطلاعات سه بعدي از تصاوير دو بعدي است. پردازش تصوير به معناي ارتقاء كامپيو تري تصاوير ديجيتال است (يعني استفاده از انواع فيلترها براي حذف نويز، بهينه سازي كنتراست و (….
آناليز كامپيوتري تصاوير استخراج كمي و يا كيفي خصوصيات تصاوير ديجيتال دوبعدي و يا سه بعدي است. به عنوان مثال آناليز تصاوير دو بعدي در ديد كامپيوتري و آناليز تصاوير سه بعدي در تصوير برداري پزشكي كاربرد دارد. آناليز تصوير در واقع استخراج اطلاعات از درون تصوير است مثل استخراج انواع سطوح، محيط ها و طول ها و …
تصوير برداري ديجيتال

يك تصوير ديجيتال [I[m,n در يك فضاي گسسته دو بعدي در واقع از يك تصوير دو بعدي مشتق (I(x,y در يك فضاي پيوسته دو بعدي توسط فرايند نمونه برداري به نام digitization مي شود.تصوير دو بعدي به n رديف و m ستون تقسيم مي شود (شكل۱).
تصوير شماره۱به ۱۶رديف و ۱۶ستون تقسيم شده كه هر پيكسل آن گرد شده مقدار روشنائي به نزديك ترين عدد صحيح است.
دقت تصوير به صورت پيكسل بر اينچ اندازه گيري مي شود. يك تصوير با دقت ۱۰۰۰۰PPI در يك اينچ مربع داراي پيكسل است. براي انجام آناليز تصوير لازم است ويژگي هاي مورد نظر به گونه اي استخراج شوند تا اندازه گيري ها بر روي تصاوير پيكسلي شده انجام نشود.
دقت پيكسلي يا عمق پيكسل به معني تعداد بيت اطلاعات به ازاء هر پيكسل است. عمق پيكسل مشخص مي كند چه مقدار اطلاعات مربوط به رنگ و يا طيف خاكستري براي هر پيكسل امكان پذير است. در تصاوير باينري عمق پيكسل۱ (روشن – خاموش) است. اين ها تصاوير سفيد وسياه است. براي آناليز تصاوير طيف خاكستري حداقل عمق پيكسل لازم ۸بيت است. براي تصاوير رنگي حداقل عمق ۲۴بيت لازم است.قانون نيكوئيست بيان مي كند كه اگر مي خو اهيم به صورت ديجيتالي دقت جزئيات حفظ شود بايد dpi تصويربرداري دو برابر دقت ويژگي مورد نظر باشد.
المان هاي تفسير توسط چشم
همان طور كه قبلا گفته شد، آناليز تصوير شامل شناسائي اهداف متفاوتي درون تصوير است. اين اهداف ممكن است ويژگي هاي محيطي يا مصنوعي باشند كه از نقاط، خطوط يا نواحي تشكيل شده اند.
چه چيز تفسير تصاوير را نسبت به تفسير چشمي روزمره مشكل مي سازد؟
در تصاوير دو بعدي فرد حس مربوط به عمق را از دست مي دهد مگر آن كه بتواند آنرا به صورت استريوسكوپي ببيند تا عمق آن شبيه سازي شود. در واقع در ديد استريوسكوپي تفسير بسيار آسان تر خواهد بود. يك پرسپكتيو غير معمول اگر با جزئيات كم و اندازه بسيار نامتعارف ادغام شود مي تواند آشنا ترين اشياء را غير قابل تشخيص كند. همچنين چشم انسان در محدوده مشخصي از طول موج مي تواند عمل كند و تصوير برداري خارج از اين محدوده مي تواند جهت درك بسيار مشكل باشد.
تشخيص هدف ها كليد استخراج اطلاعات و تفسير تصوير است. مشاهده اختلاف بين هدف ها و زمينه آن ها شامل مقايسه از نظر تعدادي از المان هاي بينائي يعني تون، شكل، اندازه، الگو، سايه و ارتباط است. تفسير بينائي روزمره انسان توسط استفاده از اين المان ها صورت مي گيرد. اكنون به توضيح هر يك از اين موارد پرداخته مي شود:
تون
به روشنائي يا رنگ نسبي اشياء در تصوير اتلاق مي شود. عموما، تون مهمترين المان براي تمايز بين هدف ها يا ويژگي هاي مختلف است. تغييرات تون مي تواند باعث تمايز المان هاي شكل، بافت و الگو شود.
شكل
بيان كننده فرم، ساختار و محيط اشياء است. شكل مي تواند در تفسير بسيار متمايز كننده باشد. اشكال طبيعي بيشتر شكل نامنظم و ساخته هاي دست بشر بيشتر لبه هاي مستقيم دارد.
اندازه
اندازه تصاوير تابعي است از بزرگنمائي تصوير. بسيار مهم است كه در تفسير تصاوير اشياء از نظر اندازه با اشياء ذيگر و با اندازه واقعي تصوير مقايسه شوند.
الگو
الگو بيان كننده ترتيب قرار گرفتن فضائي اشياء ديدني است. به طور مشخص تكرار منظم تون ها و بافت هاي مشابه مي تواند بيان كننده يك الگو باشد.
بافت
به ترتيب و تكرار تغييرات تون در نواحي خاصي از تصوير اطلاق مي شود. در بافت هاي خشن تغييرات تون خاكستري در يك ناحيه كوچك به ميزان زياد به چشم مي خورد ولي در بافت هاي ملايم تغييرات تون خاكستري بسيار كم است.
سايه
سايه نيز مي تواند در تفسير تصاوير بسيار كمك كننده باشد. سايه مي تواند ارتفاع نسبي اشياء را مشخص سازد. البته گاهي سايه ها مي توانند تشخيص اهداف را مشكل سازند زيرا اهدافي كه در درون سايه قرار دارند كمتر قابل تشخيص خواهند بود. سايه ها براي تشخيص توپوگرافي نيز مي توانند كمك كننده باشند.
ارتباط
ارتباط، رابطه بين هدف و ديگر اشيائ قابل تشخيص در نزديكي آن را در نظر مي گيرد. اين مساله مي تواند به تشخيص مواردي كه اين رابطه شناخته شده است كمك كند. مثلا در يك تصوير ماهواره اي، ساختمان هائي كه نزديك مسير هاي اصلي ديده مي شود به احتمال زياد ساختمان هاي تجاري است.
طبقه بندي اشيا توسط انسان
انسان براي دسته بندي اشياء از روش شناخت الگو بر اساس قرار گرفتن در معرض چندين نمونه استفاده مي كند. انسان هميشه يك الگوي ذهني از اشياء درست مي كند كه اين الگو با ديگر اطلاعات مربوط به شيء به همراه مقداري عينيت بخشي اين قابليت را مي دهد كه انسان سريعا شيء را دسته بندي كند ولي هميشه يك المان ذهني وجود دارد.
انسان به كنتراست حساس است. هميشه اشيائي كه كنتراست بالا دارند بيشتر در ذهن خود را نشان مي دهند.
انسان به پرسپكتيو و تغييرات عمق تصوير حساس است.
انسان به جهت تابش نور حساس است و ترجيح مي دهد كه نور از بالا بتابد.
انسان هميشه دوست دارد چيزي را در تصوير ببيند كه انتظار آن را دارد.
پردازش تصویر (Image processing) و پزشکی
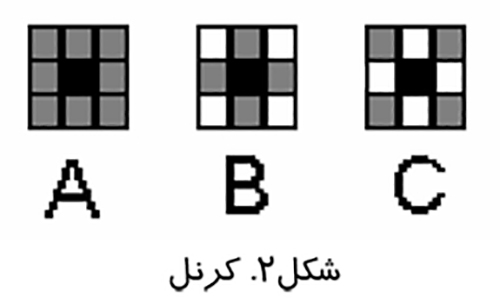
پردازش تصوير عملياتي است كه طي آن ويژگي هاي تصوير بارزتر مي شوند و قبل از آناليز تصوير انجام مي گيرد. پردازش تصوير بر روي پيكسل ها يعني كوچك ترين اجزاي تصوير انجام مي شود. الگوريتم هاي مختلفي كه در پردازش تصوير استفاده مي شوند عمليات خود را بر روي گروهي از پيكسل ها انجام مي دهند. به اين گروه ها كرنل (Kernel) گفته مي شود.در شكل (۲) يك سري از كرنل هاي ۳×۳خود را بر روي پيكسل وسط يا سياه رنگ، با استفاده از اطلاعات موجود در پيكسل هاي همسايه اعمال مي كنند.
در كرنل A اطلاعات تمام پيكسل هاي همسايه در عمليات پردازش نقش دارد . در كرنل B تنها اطلاعات همسايه هاي با ارزش (همسايه هاي عمودي و افقي) در نظر گرفته مي شود. در كرنل C اطلاعات پيكسل هاي همسايه ضعيف يعني همسايه هاي مورب مورد استفاده قرار مي گيرد. انواع متفاوت اين كرنل ها مبناي پردازش ديجيتالي تصاوير است.
پيش پردازش (Preprocessing)
عمليات پيش پردازش كه گاهي بازيابي يا اصلاح تصوير نيز ناميده مي شود به منظور اصلاح اعوجاج هاي راديومتريك يا ژئومتريك مربوط به سنسور و سكو به كار برده مي شود. اصلاحات راديومتريك به دليل تغييرات در هنگام روشن سازي صحنه و جهت هاي تصوير برداري، شرايط محيطي و نويز گيرنده است. اين موارد و ابسته به سنسور، سكو و شرايط تصوير برداري است. تغيير داده ها به اشعه هاي اصلي تشكيل دهنده تصوير براي آسان سازي مقايسه بين داده ها مطلوب است.
تغييرات در نورپردازي و اشكالات هندسي را مي توان با استفاده از مدل كردن وضعيت هندسي و فاصله بين شيئ و گيرنده و منبع نور اصلاح كرد. اين عمل نياز است تا بتوان تصاوير بدست آمده در شرايط و زمان ها و با گيرنده هاي مختلف را با يكديگر مقايسه كرد و يا تصاوير بدست آمده از يك گيرنده را به صورت موزائيك در كنار يكديگر قرار داد و نتيجه مطلوبي بدست آورد.
در تصوير برداري پزشكي اختلالات عمده شامل نويز ناشي از دريافت با فركانس بالا، روشنائي متفاوت در زمينه و مشكلات ناشي از جهت گيري دور مشاهده مي شود. به همين دليل پيش پردازش ها به طور سيستماتيك بر روي تمام تصاوير گرفته شده از يك دستگاه اعمال مي شوند. به همين دليل اين پردازش ها معمولا وابسته به دستگاه هستند و بايد سريع و موثر باشند. هنگامي كه خصوصيات فضائي يا روشنائي نويز ها مشخص باشد از متدهاي فوتوگرامتريك استفاده مي شود.
وقتي خصوصيات طيفي نويز ها مشخص باشد از فيلتر ها استفاده مي شود. فيلتر هاي پايين گذر براي حذف نويز ها، فيلتر هاي ميان گذر براي نويز هاي پريوديك و فيلتر هاي بالا گذر براي تيز كردن تصاوير به كار برده مي شوند. يك گروه الگوريتميك از فيلتر ها هنگامي كه يك شئ خاص مورد نظر باشد به كار برده مي شوند. اين در صورتي است كه نوع هاي ديگري از همان شيء با زوايا و ديگر خصوصيات متفاوت وجود داشته باشد. بايد توجه داشت كه مرحله پيش پردازش نبايد به گونه اي باشد كه تصوير اصلي را آنقدر تغيير دهد كه بيننده دچار خطاي تشخيص شود.
ارتقاي تصوير(Image Enhancement)
ارتقا کیفیت تصویر توسط دستكاری هيستوگرام
ارتقاء تصوير به منظور آسان سازي تفسير بينائي و درك تصوير به كار برده مي شود. مزيت تصاوير ديجيتال در اين است كه مي توان يك نقطه را دستكاري كرد. حتي بعد از پيش پردازش و اصلاح خطاهاي ناشي از گيرنده و جهت، ممكن است تصوير براي بيننده وضوح كافي نداشته باشد. اگر اهداف مختلف داراي طيف هاي مختلفي از روشنائي است پردازش هاي اوليه نمي تواند همه آنها را به طور مطلوب نشان دهد. به همين دليل براي هر تصوير بايد تنظيم خاصي از نظر روشنائي و پراكندگي آن وجود داشته باشد.
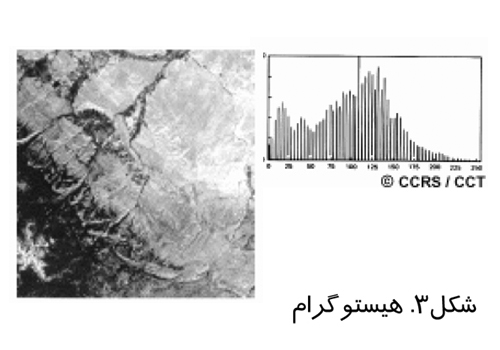
در تصوير برداري روزمره تنها از ظرفيت كمي از قابليت تصوير برداري ديجيتال مثلا ۸بيت استفاده مي شود. ارتقاي كنتراست بدين معنا است كه از ظرفيت بيشتري براي نشان دادن كنتراست استفاده شود و اشياي در تصوير مشخص تر باشند. براي درك بهتر ارتقاي كنتراست بايد هيستوگرام را شناخت. يك هيستوگرام يك نمودار گرا فيكي است كه مقادير روشنائي كه يك ها تصوير ر ا مي سازند مشخص مي سازد. مقادير روشنائي در محور x ها و ميزان تكرار يا فركانس هركدام از اين مقادير در تصوير روي محور yها نشان داده مي شود. شکل(۳)، يک تصوير نمونه به همراه هيستوگرام آن را نشان مي دهد.
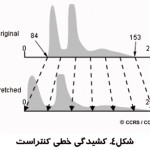
با استفاده از دستكاري محدوده مقادير ديجيتال يك تصوير، كه در هيستوگرام آن نشان داده شده، مي توان تصوير را بهبود داد. روش هاي مختلفي براي ارتقاي كنتراست وجود دارد. ساده ترين روش كشيدن خطي كنتراست است .بدين صورت كه حد بالا و پايين كنتراست از روي هيستوگرام مشخص مي شود سپس با استفاده از يك تبديل، محدوده كنتراست كشيده مي شود تا كل محدوده ممكن را پر مي كند.شکل(۴) نحوه انجام اين کار را نشان مي دهد. نتيجه اعمال اين روش در شکل(۵) نشان داده شده است.

اين عمل هميشه منجر به نتيجه مناسب نمي شود به خصوص در مواردي كه محدوده ورودي به طور يكنواخت پراكنده نباشد. در اين موارد از روش كشيدگي هيستوگرام تعديل شده (Histogram Equalized stretch) استفاده مي شود. در اين روش محدوده بيشتري به مقاديري كه فركانس بالاتري دارند اختصاص مي يابد. در اين روش جزئيات دقيق تري از نواحي كه بيشتر تكرار شده است در مقايسه با نواحي كه كمتر تكرار شده نشان داده مي شود. در برخي موارد ممكن است فقط در يك محدوده خاص از هيستوگرام بخواهيم تصوير را ارتقا دهيم در مواردي كه هيستوگرام در يك طرف طيف يا در وسط طيف جمع شده باشد و تصوير تيره يا روشن به نظز برسد مي توان از روش Histogram sliding استفاده كرد. در اين روش يك مقدار ثابت به كل پيكسل ها اضافه و يا از آن ها كم مي شود.
بايد دقت داشت كه اين روش ها رزولوشن تصوير را بالا نمي برند بلكه ويژگي هاي مورد نظر در تصوير را بهبود مي دهند. گاما (Gamma) در يك هيستوگرام، همان شيب نمودار است و به معني نسبت تغييرات خروجي به تغييرات ورودي است. مقدار گاماي ۱بيانگر نسبت ۱:۱خروجي به ورودي است و نياز به اصلاح ندارد. در برخي برنامه ها يك تابع گاما يك تابع جستجوكننده در جدول استفاده مي كندتا خطاهاي ايجاد شده در تصوير را اصلاح كند.
حذف نويز
در مواردي كه تصوير در نور كم گرفته شود نسبت نويز به سيگنال بالا مي رود. يك روش براي كاهش اين نويز استفاده از ميانگين گيري است به اين صورت كه فريم هاي متعددي از تصوير گرفته مي شود و ميانگين آن ها به عنوان تصوير نهائي در نظر گرفته مي شود كه حاوي اطلاعات بيشتر و نويز كم تر است البته استفاده از اين فيلترها مقداري تاري در تصوير ايجاد مي كند. استفاده از آن ها در تصاوير دقت بالا توصيه نمي شود. فيلتر كردن فضائي در مواردي به كار مي رود كه بخواهيم ويژگي هائي از تصوير را بر اساس تكرار فضائي آن ها بهبود يا کاهش دهيم. فركانس فضائي با بافت تصوير مرتبط است و اشاره دارد به ميزان تكرار تغييرات تون در تصوير. نواحي خشن كه تغييرات تون در آن ها زياد است فركانس فضائي بالاتر نسبت به نواحي ملايم دارند. در يك روش يك پنجره شامل ابعادي كوچك بر روي تصوير پيكسل به پيكسل حركت مي كند و بر اساس مقادير پيكسل ها با استفاده از روابط رياضي مقداري محاسبه و به جاي پيكسل مركز قرار داده مي شود. اين عمل بر روي كل تصوير انجام مي شود. با اين روش نيز مي توان با استفاده از فيلتر، تصوير را ارتقا داد.
فيلتر پايين گذر به منظور تاكيد بر نواحي بزرگ و هوموژن داراي تون يكسان و كاهش جزئيات كوچك تر به كار مي رود. پس تصوير را هموارتر مي كنند. اين فيلتر در تصوير برداري رادار استفاده مي شود. فيلتر بالا گذر عكس آن عمل مي كند و باعث افزايش جزئيات و تيز شدن تصوير مي شود.
فيلترهاي تشخيص لبه يا جهت دار به منظور شناسائي ويژگي هاي خطي طراحي شده اند. اين فيلترها به منظور تشخيص ويژگي هائي كه در يك جهت خاص قرار داده شده اند نيز هستند.
فيلتر هاي ميانه كمترين ميزان بلوري را ايجاد مي كند .اين فيلتر ها با استفاده از يك كرنل ۳×۳يا ۵×۵، روشنائي پيكسل وسط يا هدف را بر اساس ميانه روشنائي پيكسل هاي همسايه تغيير مي دهد. در نتيجه يك تركيب از روشنائي در يك محدوده به وجود مي آيد. اين فيلتر پيكسل هائي كه روشنائي بسيار متفاوتي با همسايه ها داشته باشند را در نظر نمي گيرد. شکل(۵)، نتيجه اعمال فيلتر ميانه را نشان مي دهد.
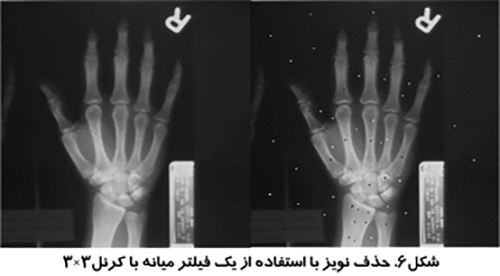
نويزهاي پريوديك در يك تصوير را عمدتا مي توان با استفاده از يك تبديل فوريه دو بعدي حذف كرد. تبديل فوريه تصوير مي تواند نويز پريوديك را مشخص سازد. اين نويز را مي توان از تصوير حذف كرد و با انجام عكس تبديل فوريه بر روي تصوير، تصوير بدون نويز را بدست آورد. شكل (۶)، حذف نويز پريوديك با استفاده از تبديل فوريه سريع (Fast Fourier Transform-FFT) را نشان مي دهد.
بهبود لبه ها
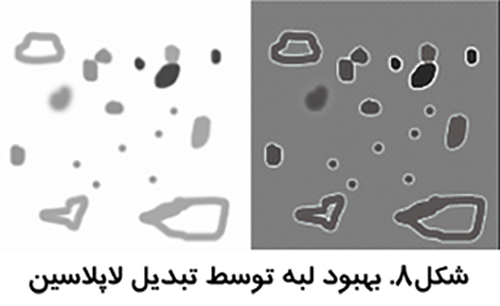
در اين روش ها وضوح تصوير كاهش مي يابد و لبه هاي موجود در آن بهبود مي يابند. اين روش ها همانند استفاده از فيلتر بالا گذر هستند ولي با اين تفاوت كه به لبه ها اهميت ويژه اي مي دهند نه به اختلاف كنتراست دو قسمت از تصوير. يكي از معروف ترين آن ها، بهبود لبه لاپلاسين است كه بدون توجه به جهت لبه ها آن ها را مشخص تر مي سازد (شکل7)

استفاده از رنگ مجازي
بينائي انسان به رنگ حساس تر است. استفاده از رنگ مجازي در تصاوير طيف خاكستري مي تواند برخي جنبه هاي تصوير را نمايان تر سازد (شکل8).
تبديل تصاوير(Image Transformation)
عمدتا تبديل تصاوير نيازمند دستكاري چندين باند داده است چه از يك تصوير چند طيفي يا از دو يا بيشتر تصوير از يك ناحيه كه در زمان هاي مختلفي گرفته شده است (مولتي تمپورال). تبديلات پايه شامل اعمال عملگر هاي جبري بر روي داده ها است. كم كردن تصاوير از يكديگر معمولا براي مواقعي كه مي خواهيم بدانيم در طول زمان چه تغييراتي رخ داده است بكار برده مي شود (کاربرد در آنژيوگرافي). ابتدا دو تصوير كه از نظر خطاهاي هندسي تثبيت شده اند، مقادير پيكسل هايشان از يكديگر كم مي شود و يك مقدار ثابت به پيكسل هاي تصوير حاصله اضافه مي شود (مثلا عدد ۱۲۰). تصوير نهائي نتيجه خوبي از تغييرات است. در چنين تصويري نقاطي كه اختلاف كمي در دو تصوير اوليه دارند داراي روشنائي ۱۲۰مي شوند ولي نقاطي كه اختلاف بيشتري دارند پس از تبديل داراي روشنائي بيشتر يا كمتر از ۱۲۰خواهند بود.شکل(۹)، نتيجه اجراي اين روش را نشان مي دهد.

تقسيم كردن تصاوير يا Spectral rationing يكي از متداول ترين تبديلات بر روي تصاوير است. اين روش براي روشن ساختن تغييرات كوچكي كه در طيف پوششي سطح هاي مختلف وجود دارد، به كار برده مي شود.يكي از محاسن استفاده از اين روش اين است كه به دليل اين كه فرد به مقادير به صورت نسبي نگاه مي کند و نه مقادير مطلق روشنائي، تغييرات نور پردازي ناشي از اثرات توپوگرافيك خود را كمتر نشان مي دهند.
باند هاي متفاوت از داده هاي چند طيفي معمولا به شدت با يكديگر مرتبطند و بنابراين اطلاعات مشابهي را در خود دارند. تكنيك هاي تبديل تصوير كه ويژگي هاي آماري داده هاي چند طيفي را پردازش مي كنند به منظور كاهش اين افزونگي داده استفاده مي شوند. يكي از اين تكنيك ها آناليز اجزائ اصلي (Principal Components Analysis) است. هدف اين تبديل كاهش تعداد باندها و فشرده سازي اطلاعات باندهاي اوليه در تعداد كمتري از باندها است.باندهاي جديد بدست آمدهcomponent نام دارند و حاوي بيشترين اطلاعات در كمترين تعداد باند هستند.
آناليز تصاوير (Image Analysis)
پس از اين كه تصاوير از نظر كيفي بهبو يافتند در مرحله بعد بايد ويژگي هاي آن ها مشخص و استخراج شوند. بيشتر داده هاي تصاوير ممكن است به نواحي با محيط بسته، نقاط و خط ها تقسيم و دسته بندي شوند. براي شناسائي اشياء بايد بتوان آن ها را از زمينه متمايز و جدا كرد. معمولا بهتر است تصوير طيف خاكستري به تصوير باينري (سياه و سفيد) تبديل شود. تكنيك هائي مثل تقسيم تصوير و شناسائي لبه بر روي تصاوير باينري بهتر اجرا مي شود ولي بر روي تصاوير طيف خاكستري يا رنگي نيز گاهي اعمال مي شوند. بيشترين پارامتر هائي كه در آناليز تصوير اندازه گيري مي شوند شامل موارد زير است:
طول: اندازه يك خط كشيده شده
سطح: سطح پيكسلهاي درون يك شيء
محيط: فاصله اطراف محيط يك شيء در واحد پيكسل
نسبت سطح به محيط: مقداري براي اندازه گيري ميزان گرد بودن يا فشرده بودن. مقدار آن بين صفر و يک است.
محور اصلي:محوري كه بزرگ ترين خط را در درون شيء تشكيل مي دهد.
محور فرعي: بزرگ ترين محوري كه مي توان در درون شيء عمود بر محور اصلي در نظر گرفت.
تعداد حفره ها:تعداد حفره هايي كه در درون شيء موجود است.
بايد توجه داشت كه هيچ روش قطعه سازي تصويري وجود ندارد كه بر روي تمام تصاوير عمل كند. همچنين هيچ روش قطعه سازي كامل نيست.
تعيين آستانه( Thresholding)
ساده ترين روش بر اي قطعه كردن تصوير استفاده از تكنيك هاي تعيين آستانه است. تعيين آستانه مي تواند بر روي تصاوير مونوكروم يا رنگي انجام شود. در موارد مونوكروم، پيكسل هاي يك محدوده خاص از طيف خاكستري بر روي مانيتور نمايش داده مي شوند و آناليز بر روي آن ها صورت مي گيرد.سوال اساسي در اين روش اين است كه آستانه را چگونه بايد مشخص كرد؟ با اين كه جوابي براي اين سوال وجود ندارد كه بر روي تمام تصاوير عمل كند ولي راه هائي براي اين كار وجود دارد:
آستانه ثابت (Fixed threshold)
يك روش انتخاب آستانه بدون توجه به داده هاي تصوير است. اگر مشخص باشد كه تصوير مورد نظر داراي كنتراست بالاست و اشياء بسيار تيره است و زمينه يكنواخت و روشن است، در اين صورت يك آستانه كنتراست ۱۲۸در محدوده ۰تا ۲۵۵مي تواند دقيق باشد. منظور از دقت اين است كه پيكسل هاي اشتباه انتخاب شده حداقل باشد.
آستانه هاي به دست آمده از هيستوگرام(Histogram-derived thresholds)
در بيشتر موارد آستانه از هيستوگرام روشنائي تصوير يا ناحيه مورد نظر جهت تقسيم كردن انتخاب مي شود. تعدادي از روش هاي تعيين آستانه جهت تعيين خودکار آستانه كه از هيستوگرام طيف خاكستري شروع مي شود ارائه شده اند. تعدادي از آن ها در اين قسمت ارائه مي شود. در بيشتر اين الگوريتم ها، ساده سازي داده هاي هيستوگرام خام مفيد واقع مي شود ولي اين ساده سازي نبايد به گونه اي باشد كه پيک هاي هيستوگرام را جابجا كند. اين مساله منجر به استفاده از يك الگوريتم ساده سازي فاز صفر مي شود و مقدار W مي تواند ۳يا ۵باشد.
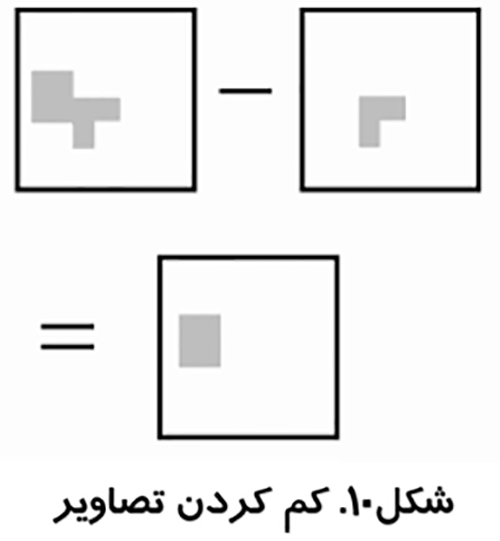
در شكل ۱۰پيكسل هاي زير آستانه به عنوان پيكسل هاي شيء و پيكسل هاي بالاي آستانه به عنوان پيكسل هاي زمينه در نظر گرفته مي شوند.
الگوريتم ايزو ديتا
اين تكنيك تكرار شونده براي انتخاب آستانه توسط ريدلر و كالوارد ايجاد شد. در ابتدا هيستوگرام با استفاده از يك مقدار آستانه به دو قسمت تقسيم مي شود. اين آستانه معمولا نصف مقادير ممكن مي تواند باشد. ميانگين مقادير خاكستري نمونه ۰، f و m مربوط به پيكسل هاي foreground و ميانگين مقادير خاكستري نمونه۰، b و m مربوط به زمينه محاسبه مي شوند. يك مقدار آستانه جديد به نام teta1 به صورت ميانگين دو مقدار بدست آمده محاسبه مي شود. اين فرايند بر اساس مقادير جديد به طور مرتب تكرار مي شود تا زماني كه مقدار آستانه ديگر تغييري نكند.
الگوريتم Background – symmetry
اين روش در نظر مي گيرد كه قله مشخص و واضح براي زمينه وجود دارد كه نسبت به ماكسيمم حالت قرينه دارد. در اين تكنيك نيز بهتر است از روش ساده سازي استفاده شود. تعيين قله ماكسيمم (maxp) توسط جستجوي بيشترين مقدار در هيستوگرام انجام مي گيرد. سپس الگوريتم در پيكسل هاي طرف نامربوط به اشياء آن قله به دنبال يك نقطه p% است.
به عنوان مثال در شكل ۱۰كه پيكسل هاي شيء در طرف چپ قله زمينه در مقدار ۱۸۳قرار دارند، بدان معني است كه در سمت راست قله بايد جستجو شود تا مقدار مثلا % ۹۵يافت شود. در اين مقدار روشنائي، ۵%پيكسل ها در طرف راست يا بالاتر قرار مي گيرند و اين مساله در مقدار ۲۱۶اتفاق مي افتد. به دليل تقارن در نظر گرفته شده ما آستانه را مقداري در نظر مي گيريم كه مقدار ماكسيمم به اندازه اختلافش تا مقدار p%به سمت چپ تغيير مكان دهد. يعني مقدار آستانه معادل مي شود با ۱۵۰= ۱۸۳ – (۲۱۶-۱۸۳)
اين تكنيك به راحتي قابل تبديل به مواردي است كه شيء روشن بر روي زمينه تاريك قرار دارد. همچنين در مواردي كه قله مربوط به شيء بزرگ تر است و روشنائي مربوط به آن در اطراف قله به صورت متقارن پخش شده است نيز قابل استفاده است.
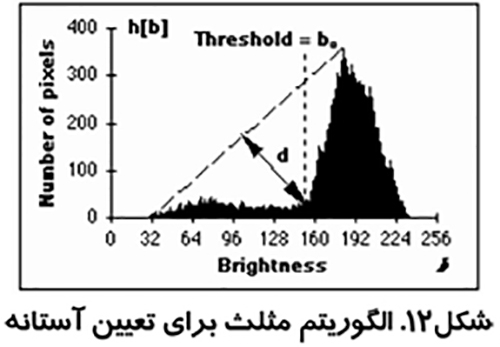
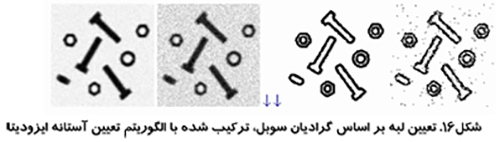
الگوريتم مثلث و پردازش تصویر در پزشکی
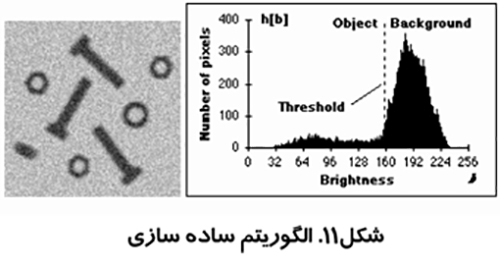
اين روش كه در شكل (۱۱) نشان داده شده است توسط زاك مطرح شد. از بلند ترين نقطه هيستوگرام خطي به كوتاه ترين نقطه آن كشيده مي شود. فاصله بين خط و هيستوگرام (d) براي تمام مقادير b از b min تا b max محاسبه مي شود. مقدار روشنائي b0 كه فاصله بين h(b0) تا خط بيشترين مقدار را داشته باشد به عنوان آستانه تعريف مي شود. اين تكنيك زماني موثر است كه قله مربوط به شيء ضعيف باشد.
تعيين آستانه نبايد بر روي كل تصوير اعمال شود بلكه مي تواند به صورت ناحيه به ناحيه اعمال شود. چو و كانكو روشي را ابداع كردند كه در آن تصوير m*n به نواحي جدا از هم تقسيم مي شود. در هر ناحيه يك آستانه مشخص شده و پس از تعيين تمام آستانه ها، همه مقادير آن ها در تعيين يك سطح آستانه براي كل تصوير استفاده مي شوند. اندازه ناحيه ها بايد منطقي باشد و داراي تعداد كافي پيكسل به منظور تعيين هيستوگرام و آستانه باشند. كاربرد اين روش بستگي به نحوه استفاده و مهارت فرد دارد.
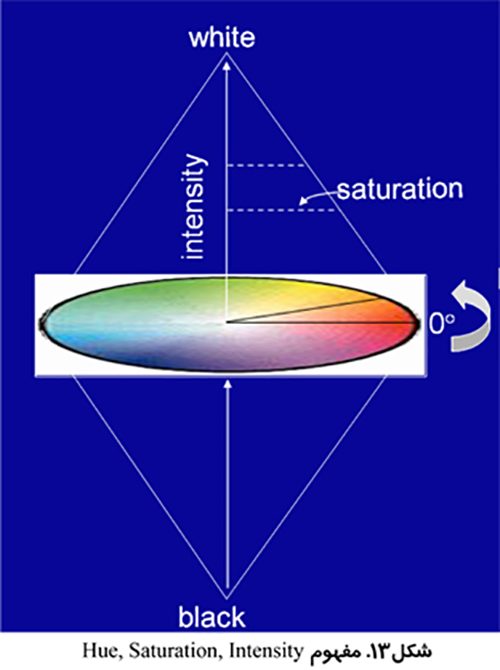
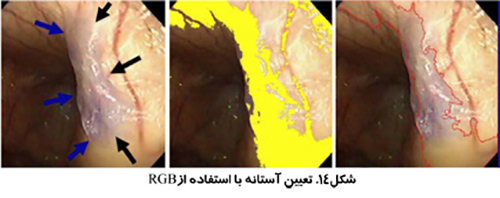
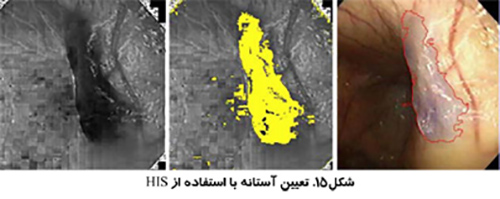
استفاده از تصاوير رنگي مي تواند تمايز بيشتري به همراه داشته باشد. بخش بندي تصوير مي تواند انجام بر اساس رنگ هاي قرمز، سبز و آبي (RGB) انجام شود و يا بر اساس روش رنگ، اشباع و شدت (HSI) كه روشي قدرتمند تر است. روش HSI به مغز انسان براي تشخيص اشياء نزديك تر است. Hue به معني طول موج رنگ، Saturation بيانگر درجه خلوص رنگ و Intensity نشان دهنده ميزان روشنائي يا تاريكي نسبي است.
تشخيص لبه
يكي ديگر از روش هاي بخش كردن تصوير، تشخيص لبه است. در روش تعيين آستانه تصوير به پيكسل هائي تقسيم مي شود كه هر كدام اصولا به يك شيء مورد نظر اختصاص مي يابند. حالت ديگري وجود دارد و آن اين است كه پيكسل هائي جستجو شوند كه به كناره اشياء اختصاص دارند. تكنيك هاي مربوط به اين عمل، تكنيك هاي تشخيص لبه ناميده مي شوند. رياضيات شكل شناسي بيان مي كند كه يك رابطه ذاتي بين لبه ها و نواحي وجود دارد. فيلترهاي تشخيص لبه زيادي وجود دارد از جمله لاپلاس، سوبل، کني، پرويت و روبرتز كه مي توانند اشياء را تشخيص و ارتقا دهند. اين فيلتر ها گراديان ها را برجسته مي سازد و تحول از يك روشنائي به ديگري را تشخيص مي دهد. با اين حال اين فيلتر ها اشياء ناپيوسته و اشيائي را كه روي هم افتاده باشند تشخيص نمي دهند. الگوريتم هائي ممكن است استفاده شوند تا لبه هاي نزديك به هم به يكديگر بچسبند. همچنين فيلترهاي آب پخشان (Watershed) مي توانند اشياء روي هم افتاده را جدا كنند.
روش بر اساس گراديان(Gradient-based procedure)
چالش اصلي در تكنيك هاي تشخيص لبه يافتن روش هايي است كه مي توانند يك محيط بسته را در اطراف اشياء مورد نظر ايجاد كنند. براي اشيائي كه داراي SNR بالا هستند مي توان گراديان را محاسبه كرد و سپس از يك آستانه مناسب استفاده نمود.
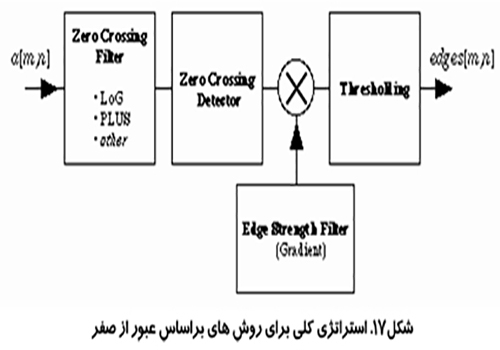
روش عبور كردن از صفر (Zero-crossing procedure)
يك نماي پيشرفته تر براي حل مشكل تشخيص لبه در تصاوير پر از نويز استفاده از روش هاي عبور كردن از صفر در لاپلاس يك تصوير است. اين روش از يك مدل ايده آل لبه آغاز مي شود، يك تابع پله ، كه توسط يك OFT تار شده است و شكل زير حا صل مي شود:
بر اساس مدل محل لبه در نقطه اي از تصوير است كه لاپلاسين تغيير علامت مي دهد يعني از صفر عبور مي كند. به دليل اين كه عمل لاپلاسين شامل مشتق دوم است اين احتمال وجود دارد كه در تصوير هاي داراي فركانس فاصله اي بالا نويزها ارتقا يابند. براي جلوگيري از ارتقاء نويز ها در هنگام جستجو براي منطقه عبور از صفر، يك عمليات هموار سازي لازم است انجام گيرد.
يك فيلتر هموار سازي مناسب از ميان فيلترهاي موجود، طبق نظر كني بايد دار اي خواص زير باشد:
– در دامنه فركانس، فيلتر بايد تا حد ممكن باريك باشد تا بتواند نويز هاي فركانس بالا را كاهش دهد.
– فيلتر بايد تا حد ممكن باريك باشد تا بتواند در دامنه فضائي (spatial domain) به خوبي لبه ها را مكان يابي كند. يك فيلتر عريض اين عدم اطمينان را دارد كه در محدوده خود فيلتر، لبه دقيقا كجا قرار گرفته است.
فيلتر هموار سازي كه به طور همزمان هر دوي اين خصوصيات را داشته باشد، فيلتر گاوسين است. اين بدان معني است كه تصوير بايد با يك گاوسين مناسب هموار سازي شود، سپس لاپلاسين بر روي آن اعمال شود.
بايد توجه داشت كه ترتيب عملگرها مي تواند عوض شود و يا هر دو در يك فيلتر تركيب شوند.
روش فیلتر PLUS
از بين تمام روش هاي عبور از صفر براي تشخيص لبه، شايد دقيق ترين آن ها فيلتر PLUS باشد. اين فيلتر توسط ونبيك و وليت ساخته شد.
تمام روش هاي تشخيص لبه بر اساس عبور از صفر در لاپلاسين بايد بتوانند بين عبور از صفر و مقدار صفر تمايز قائل شوند. براي تمايز بين اين دو حالت، ابتدا كليه عبور از صفر ها را تشخيص داده و آن ها را با ۱علامتگذاري مي كنيم بقيه پيكسل ها را با ۰علامت مي زنيم. سپس تصوير حاصل را در هر پيكسل در يك مقدار تحت عنوان توان لبه ضرب مي كنيم. اندازه هاي مختلفي براي توان لبه وجود دارد كه بر اساس گراديان بدست مي آيند. اين قابليت يعني استفاده از گراديان مورفولوجيكال به عنوان مقدار توان لبه بسيار موثر است. پس از انجام ضرب، تصوير آستانه گذاري مي شود تا نتيجه نهائي به دست آيد.
روش هاي تشخيص لبه نهايتا منجر به تصاويري مي شوند كه حاوي يك سري از پيكسل هاي لبه است. اگر اين لبه ها با اشياء مورد نظر تطبيق داشته باشند بايد از يك روش پر كردن ناحيه براي بدست آوردن اشياء نهائي استفاده كرد.
استخراج منطقه (Region extraction)
اين روش ها قسمت هائي از تصوير كه از يك قاعده يكنواختي پيروي مي كند را جدا سازي مي كند. قاعدتا لازم است براي هر پيكسل موجود در هر منطقه اختلاف سطح خاكستري با ديگر پيكسل هاي آن از يك مقدار مشخصي كمتر باشد. در حالتي از اين روش فقط يك نقطه و نقاط همسايه نزديك آن در نظر گرفته مي شوند. اصولا اين روش ها منجر به تشخيص نواحي بسته و در نتيجه محيط هاي بسته مي شوند كه به راحتي قابل بررسي با روش هاي اندازه گيري مورفولوجيكال هستند. نكات منفي اين روش ها پيچيدگي آن ها است و اين كه معمولا مناطق كوچك زيادي تشخيص داده مي شوند. در اينحا معمولا پس پردازش لازم است مثل منظم سازي اشكال و حذف نواحي كوچك با استفاده از Erosion/ Dilation. به علاوه جداسازي تصاوير داراي بافت هنوز يك مشكل عمده است. در حال حاضر براي اينگونه موارد از توابع حمايت كننده فشرده مثل فيلتر هاي گيبور و يا ويولت ها استفاده مي شود.پس از اينكه اشياء جداسازي شدند، بايد با روش هائي بتوان اشياء را دسته بندي كرد.
دسته بندي تصوير (Image Classification)
يك شخص خبره براي دسته بندي كردن ويژگي هاي تصوير از المان هاي بينائي كه قبلا ذكر شد استفاده مي كند تا گروه پيكسل هاي مشابه كه ويژگي هاي خاصي را در تصوير نشان مي دهند شناسائي كند.طبقه بندي ديجيتال تصوير از اطلاعات طيفي تصوير كه توسط اعداد ديجيتال در يك يا چند باند طيفي وجود دارند استفاده مي كند و سعي مي كند كه هر پيكسل را بر اساس اين اطلاعات طيفي طبقه بندي كند. اين نوع از طبقه بندي شناسائي الگوي طيفي ناميده مي شود. به هر حال هدف اين است كه در تصوير تمام پيكسل ها به يك دسته يا تم اختصاص يابند. تصوير دسته بندي شده حاصله از يك موازئيك پيكسل ها تشكيل شده كه هر كدام به يك تم اختصاص دارند و اين تصوير لزوما يك نقشه تماتيك از تصوير اوليه است.
هنگام صحبت از طبقه بندي بايد بين طبقه بندي اطلاعاتي و طبقه بندي طيفي تمايز قائل شد. طبقه بندي اطلاعاتي بيانگر قسمت هائي از تصوير است كه فرد مايل به تشخيص آن ها است مثل انواع درخت، رودخانه و غيره در يك تصوير هوائي. ولي دسته هاي طيفي گروه هائي از پيكسل است كه از نظر مقدار روشنائي در كانال هاي طيفي مختلف داده ها متحدالشكل هستند. هدف، نگاشت دسته هاي طيفي با دسته هاي اطلاعاتي مورد جستجو است. با اين حال دسته هاي طيفي وجود دارند كه با هيچ طبقه اطلاعاتي مورد نظر فرد مطابقت ندارند. متقابلا در يك دسته اطلاعاتي بزرگ نيز ممكن است زير گروه هاي طيفي منحصر به فردي وجود داشته باشد.
عمليات طبقه بندي شايع بسته به روش هايي كه در آن ها استفاده مي شود به دو دسته عمده با سرپرست و بدون سرپرست تقسيم مي شوند. در نوع با سرپرست فرد خودش نمونه هاي مشابه بيان كننده نوع سطح پوشاننده را شناسائي مي كند. اين نمونه ها به عنوان نواحي آموزنده (Training areas) ناميده مي شوند. انتخاب اين نواحي آموزنده بسته به ميزان آشنائي فرد با بافت موجود در تصوير دارد. بنابراين فرد نحوه انتخاب گروه ها و دسته ها را نظارت مي كند. اطلاعات رقمي موجود در همه باندهاي طيفي كه تشكيل دهنده اين نواحي هستند براي آموزش كامپيوتر جهت شناسائي نواحي مشابه از نظر طيفي براي هر طبقه استفاده مي شود. كامپيوتر از روش ها و الگوريتم هاي مختلفي براي شناسائي مشخصه هاي عددي هر دسته آموزشي استفاده مي كند. هنگامي كه كامپيوتر همه دسته هاي آموزشي را شناسائي كرد، هر پيكسل تصوير با اين دسته ها مقايسه مي شود و نهايتا براي يك دسته نزديك به خودش علامتگذاري مي شود. پس در مدل داراي سرپرست، ابتدا طبقه هاي اطلاعاتي مشخص مي شود سپس از روي اين طبقه هاي اطلاعاتي، طبقه هاي طيفي كه نماينده آن ها هستند مشخص مي شود.
دسته بندي بدون سرپرست اصولا عكس نوع داراي سرپرست است. در ابتدا كلاس هاي طيفي بر اساس عدد طيفيشان مشخص مي شوند سپس با دسته هاي طيفي مد نظر فرد نگاشت مي شوند. برنامه هائي تحت عنوان الگوريتم هاي خوشه بندي براي تشخيص گروه بندي هاي طبيعي (آماري) و ساختار هاي موجود در تصوير به كار برده مي شوند. معمولا فرد مشخص مي كند كه چه تعداد گروه يا طبقه بايد در نظر گرفته شود. به علاوه، فرد مشخص مي كند كه بين طبقه ها چه مقدار فاصله تمايز وجود داشته باشد و همچنين چه مقدار تغيير در درون يك طبقه مجاز است.نتيجه نهائي اين طبقه بندي ممكن است به دسته هائي منجر شود كه فرد لازم مي داند تعدادي از آن ها ر ا به هم بپيوندد يا تعدادي را به ميزان بيشتري بشكند كه اين مساله خود نيازمند كاربرد بيشتر الگوريتم خوشه بندي است. پس طبقه بندي بدون سرپرست لزوما بدون دخالت انسان نيست ولي با نظارت اوليه يك انسان نيز شروع نمي شود.




















